・令和6年9月26日判決言渡
・東京地方裁判所民事第40部 中島基至 古賀千尋 坂本達也
・原告:ノーベルファーマ株式会社
・被告:沢井製薬株式会社
・特許6716464、6768984
・発明の名称:酢酸亜鉛水和物錠及びその製造方法
侵害訴訟のご紹介です。
ノーベルファーマ(原告)は、ノベルジン錠25mg(一般名:酢酸亜鉛水和物)を製造販売しています。効能・効果はウィルソン病、低亜鉛血症です。
またノーベルファーマは、酢酸亜鉛水和物錠の製法特許である特許6716464、6768984の特許権者です。
沢井製薬(被告)は、ノベルジン錠の後発医薬品である酢酸亜鉛錠25mg「サワイ」等を製造販売しています。
本件は、ノーベルファーマが、後発医薬品の製造方法(被告方法)が本件特許に係る発明の技術的範囲に属するものであるから、被告方法は本件特許権を侵害すると主張して、特許法100条1項に基づき後発医薬品の製造、販売などの差止めを求めるとともに、同条2項に基づき後発医薬品の廃棄を求めた事案です。
本件特許の請求項1は以下の通りです。
◆特許6716464
【請求項1】
(1)酢酸亜鉛水和物(C4H6O4Zn・2H2O)、賦形剤、崩壊剤及び溶媒の混合物を造粒した後乾燥して造粒物を得る工程、(2)該造粒物を打錠して素錠を得る工程を含み、前記工程(1)における品温が40℃未満であることを特徴とする、酢酸亜鉛水和物錠の製造方法。
◆特許6768984
【請求項1】
(1)酢酸亜鉛水和物(C4H6O4Zn・2H2O)、賦形剤、結合剤、崩壊剤及び溶媒を含む混合物を造粒した後乾燥して造粒物を得る工程、(2)該造粒物を打錠して素錠を得る工程を含み、前記工程(1)における品温が40℃未満であることを特徴とする、酢酸亜鉛水和物錠の製造方法。
請求項1には「品温が40℃未満」の限定があり、これを後発医薬品の製法が充足するかが争点になりました。【請求項1】
(1)酢酸亜鉛水和物(C4H6O4Zn・2H2O)、賦形剤、崩壊剤及び溶媒の混合物を造粒した後乾燥して造粒物を得る工程、(2)該造粒物を打錠して素錠を得る工程を含み、前記工程(1)における品温が40℃未満であることを特徴とする、酢酸亜鉛水和物錠の製造方法。
◆特許6768984
【請求項1】
(1)酢酸亜鉛水和物(C4H6O4Zn・2H2O)、賦形剤、結合剤、崩壊剤及び溶媒を含む混合物を造粒した後乾燥して造粒物を得る工程、(2)該造粒物を打錠して素錠を得る工程を含み、前記工程(1)における品温が40℃未満であることを特徴とする、酢酸亜鉛水和物錠の製造方法。
東京地裁は以下のように、充足しないと判断しました。
⑵ 被告方法への当てはめ
前記認定事実によれば、被告医薬品の医薬品製造販売承認書には「乾燥終点における製品温度は《50℃》以下とする」と記載されており、被告医薬品に係る製造指図記録書においては、いずれも、品温41.0℃以上で乾燥終了との指示がされていることからすると、被告方法における「乾燥して造粒物を得る工程」では、品温が41℃以上になることが認められる。そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであるから、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を充足するものとはいえない。
ここだけ読むとそりゃそうだよね、という感じなのですが、後発医薬品は下記図のように40℃未満でも乾燥しているようです。前記認定事実によれば、被告医薬品の医薬品製造販売承認書には「乾燥終点における製品温度は《50℃》以下とする」と記載されており、被告医薬品に係る製造指図記録書においては、いずれも、品温41.0℃以上で乾燥終了との指示がされていることからすると、被告方法における「乾燥して造粒物を得る工程」では、品温が41℃以上になることが認められる。そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであるから、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を充足するものとはいえない。
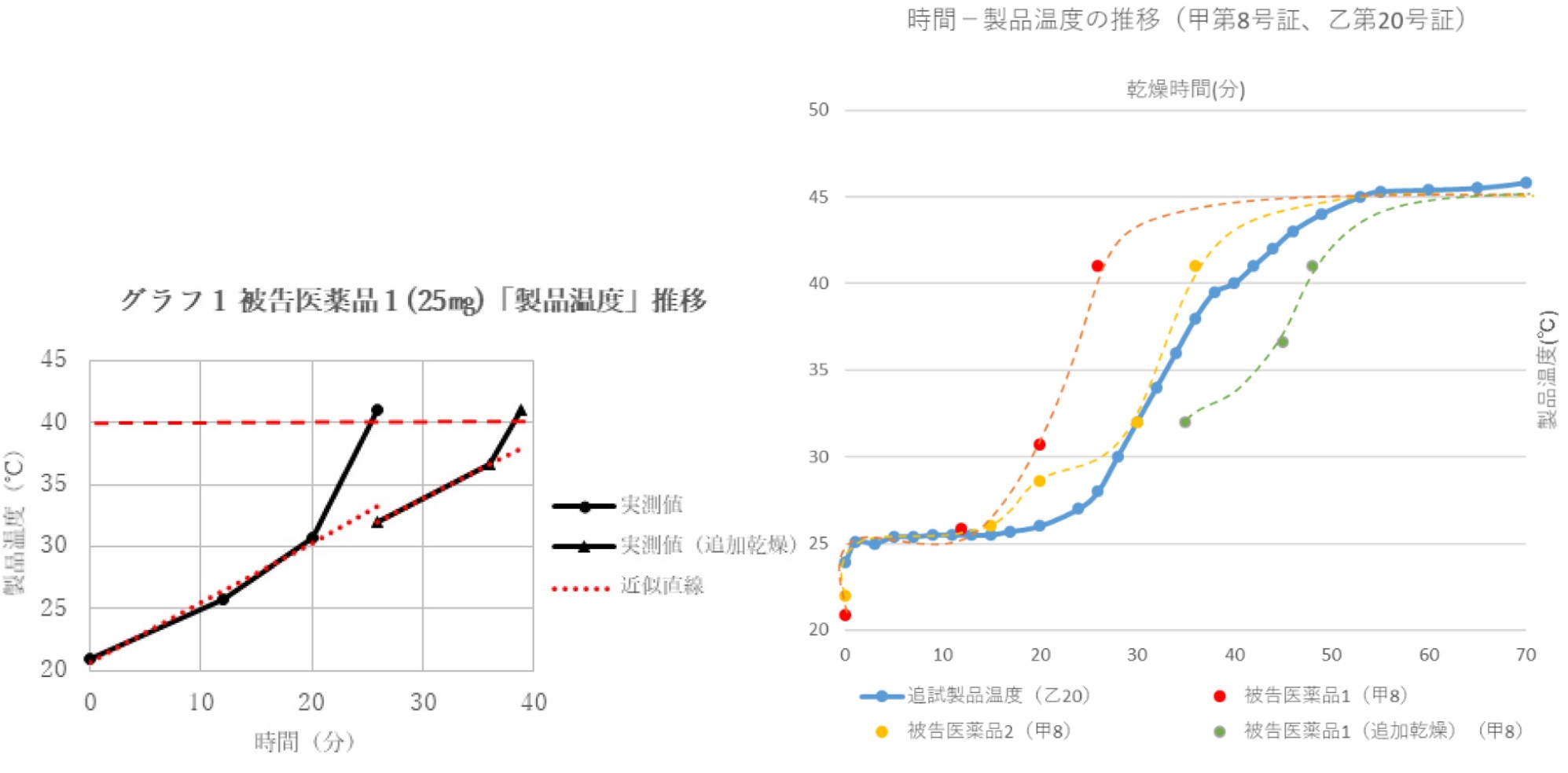
そうなると、非充足と判断されてもしょうがないかなと思います。
裁判所の判断の抜粋を以下に記載します。
判決
第4 当裁判所の判断
1 認定事実
前提事実、後掲各証拠及び弁論の全趣旨によれば、以下の事実が認められる。
・・・
2 争点1-2(「乾燥して造粒物を得る工程」における「品温が40℃未満」該当性)
⑴ 「乾燥して造粒物を得る工程」の終期
本件の争点整理の経過に鑑み、主たる争点である争点1-2のうち、中核的争点である「乾燥して造粒物を得る工程」の終期がいつであるかという点につき、まず判断する。この点につき、原告は、「乾燥して造粒物を得る工程」の終期とは、「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」(原告はこの時点までの乾燥を「必要な乾燥」といい、これ以降の乾燥を「余分な乾燥」として区分している。)である旨主張する(第4回弁論準備手続(技術説明会)調書参照)。
そこで検討するに、本件明細書に係る前記認定事実によれば、本件明細書の記載(【0010】、【0033】等)を踏まえると、本件発明の課題は、酢酸亜鉛水和物中の結晶水が消失して無水物に転移することを防ぐことにあり、その課題の解決手段としては、乾燥工程における品温を40℃未満とするものであると認めるのが相当である。そして、「乾燥」とは、一般的に熱を与えるなどして不要の液体分を取り除くことを意味するものであり(甲9、10)、本件明細書においても、上記と異なる意味で使用されているところはない。
そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであり、その終期とは、文字どおり、全ての乾燥が終了した時点であると解するのが相当である。
これを原告の上記主張についてみると、原告は、乾燥には「必要な乾燥」と「余分な乾燥」に区分され、「余分な乾燥」では40℃を超えることが許容される趣旨をいうものである。
しかしながら、本件発明の構成要件及び本件明細書を精査しても、原告が自認するように、「必要な乾燥」と「余分な乾燥」に区分されるという原告の解釈を裏付ける記載や示唆は一切なく、上記の間にある「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」という原告主張に係る概念も、本件発明の構成要件及び本件明細書に一切記載されておらず、それ自体明確性を欠くことに鑑みても、原告の主張は、その根拠を欠くものというほかない。
かえって、原告の主張によれば、「余分な乾燥」では40℃を超えることが許容されることになるから、乾燥工程における品温を40℃未満とする本件発明の課題解決手段に明らかに抵触するものとなり、本件明細書によれば本件発明の課題を解決できないことになる。そうすると、原告の主張は、本件発明の課題解決手段を正解しないものといえる。
したがって、原告の主張は、採用することができない。
⑵ 被告方法への当てはめ
前記認定事実によれば、被告医薬品の医薬品製造販売承認書には「乾燥終点における製品温度は《50℃》以下とする」と記載されており、被告医薬品に係る製造指図記録書においては、いずれも、品温41.0℃以上で乾燥終了との指示がされていることからすると、被告方法における「乾燥して造粒物を得る工程」では、品温が41℃以上になることが認められる。そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであるから、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を充足するものとはいえない。
したがって、被告方法は、構成要件1-1A及びC、1-3D、2-1A及びC、2-3Dを充足するものと認めることはできない。
⑶ 原告の主張に対する判断
ア 原告は、製造指図記録書(甲8)において、最初の乾燥工程で「20分」を過ぎた後に急速に品温が上昇していることからすると、この時点で少なくとも局所的には打錠用粉体とするための酢酸亜鉛水和物の造粒物を得るための「品温40℃未満」の条件下における「乾燥」が完了した旨主張する。
しかしながら、「必要な乾燥」と「余分な乾燥」に区分されるという原告の主張が採用できないことは、前記において説示したとおりである 。そうすると、原告の主張は、その前提を欠くものといえる。
イ 原告は、「整粒品製造指図記録書」(甲8)につき、平成28年5月2日の少量の治験薬に関するものであって、時期において7年以上も前のものであり、かつ、量的にもその生産量に大きく隔たりがある旨主張する。
しかしながら、証拠(甲8、乙36)及び弁論の全趣旨によれば、「整粒品製造指図記録書」の各作成日は、令和2年9月2日と同月7日であると認めるのが相当であり、原告の作成時期に係る主張は、その前提を欠く。また、令和4年10月(乙31、37)及び令和5年6月(乙38)の被告医薬品製造指図記録書には、被告医薬品1につき120万錠の製造が、被告医薬品2につき60万錠の製造が、それぞれ記録されていることからすれば、原告の生産量に係る主張も、その前提を欠くものといえる。
ウ 原告は、「製造指図記録書」(乙31)につき、令和4年10月4日頃に作成されたものかどうかが明らかではなく、仮に同日頃に作成されたものであるとしても、被告医薬品の販売が開始された10か月も前のものであるから、被告医薬品の量産品の製造条件を示すものであるかどうかが明らかではない旨主張する。
しかしながら、「製造指図記録書」(乙31-1、2)の上部には、「製品名」として被告医薬品1及び2の名称が明記されていること、被告医薬品の発売前2か月以内に実施された製造指図記録書【造粒】(乙38)においても、同様の記載が認められること、これらの製造指図記録書における乾燥条件が販売に至るまでに変更されたような事情をうかがわせる証拠はないこと、以上の事情を踏まえると、原告の主張は、前記判断を左右するものとはいえない。
エ 原告は、被告医薬品の製造販売承認書(乙19)の記載は、被告医薬品の実際の製造方法において加熱の終点が「50℃」付近でされていることを示すものではない旨主張する。
しかしながら、前記認定に係る被告方法の乾燥条件は、製造販売承認書のみをもって認定するものではなく、乾燥条件が具体的に記載されている製造指図記録書その他の証拠及び弁論の全趣旨を踏まえ、これを認定するものである。そうすると、原告の主張は、前記認定を直ちに左右するものとはいえない。
オ 原告は、「試験結果報告書」(乙11、20)につき、それぞれ被告医薬品との関連性が不明であるなどと主張する。
しかしながら、上記「試験結果報告書」は、結晶水の脱離時期や平衡含水率に達する品温を立証趣旨として、被告方法によっても無水物化等が生じないという被告の主張を裏付けるために実施された試験を報告するものである。そうすると、仮に上記試験における方法が被告方法と完全に同一ではなかったとしても、被告方法の乾燥工程における品温が40℃を超えるという認定を直ちに左右するものとはいえない。
カ 原告は、本件明細書の記載及び訴外日医工株式会社の公開特許公報の「比較例4」に係る記載(甲11)からすれば、品温40℃以上の状態における加熱が、結晶水の消失の抑制の観点から好ましくないことは明らかである旨主張する。
しかしながら、被告医薬品に係る製造指図記録書等を踏まえると、被告方法における品温は40℃を超えていると認められることは、前記において認定したとおりであり、仮に当該状態が好ましくないとしても、原告の主張は、本件発明の構成要件充足性を左右するものとはいえない。
のみならず、甲11の公開特許公報【0032】及び【0033】によれば、原告主張に係る実施例とは、酢酸亜鉛水和物、中鎖脂肪酸トリグリセリド(MCT)、結晶セルロース、ヒドロキシプロピルセルロース及び精製水を混合したもの(実施例17)と、このうちMCT以外を混合したもの(比較例4)につき、それぞれ造粒物の温度を5℃ずつ上昇させた場合における無水物含有率を示すものであることが認められる。
しかしながら、比較例4の混合物の構成は、被告医薬品と同一ではなく、そもそも造粒物温度40℃(無水物含有率0.9%)から45℃(無水物含有率11.6%)までの間の無水物率の変化が記載されていないことからすると、原告主張に係る実施例は、本件に適切ではなく、前記認定を直ちに左右するものとはいえない。かえって、40℃から45℃にかけて無水物含有率が大幅に上昇していることからすると、本件明細書のとおり、条件次第では40℃を超える加熱でも酢酸亜鉛水和物中の結晶水が脱離する場合があることを示唆するものともいえる。
キ 原告は、被告方法の乾燥工程及び追加乾燥工程で行われる「品温40℃以上」の状態での加熱は極めて短時間であり、造粒物に与える影響はほぼ無視し得るものである旨主張する。
しかしながら、本件発明の課題は、酢酸亜鉛水和物中の結晶水が消失して無水物に転移することを防ぐことにあり、その課題の解決手段として、乾燥工程における品温を40℃未満とするものであることは、前記において説示したとおりである。そのため、仮に、被告方法の乾燥工程における「品温40℃以上」の状態での加熱が極めて短時間であったとしても、上記の課題解決手段に明らかに反するものであり、原告主張に係る事情は、構成要件充足性を肯定し得る事情にはなり得ない。
そうすると、原告の主張は、本件発明の課題解決手段を正解しないものであって、構成要件充足性に係る前記判断を左右するものではない。
ク その他に、原告の準備書面及び提出証拠を改めて検討しても、原告の主張は、その余の主張を含め、本件発明の課題解決手段を正解しないものに帰し、前記判断を左右するに至らない。
ケ 以上によれば、原告の主張は、いずれも採用することができない。
⑷ 小括
以上によれば、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件(構成要件1-1A及びC、1-3D、2-1A及びC、2-3D)を充足するものとはいえない。
・・・
第5 結論
よって、原告の請求は理由がないからこれらをいずれも棄却することとして、主文のとおり判決する。
1 認定事実
前提事実、後掲各証拠及び弁論の全趣旨によれば、以下の事実が認められる。
・・・
2 争点1-2(「乾燥して造粒物を得る工程」における「品温が40℃未満」該当性)
⑴ 「乾燥して造粒物を得る工程」の終期
本件の争点整理の経過に鑑み、主たる争点である争点1-2のうち、中核的争点である「乾燥して造粒物を得る工程」の終期がいつであるかという点につき、まず判断する。この点につき、原告は、「乾燥して造粒物を得る工程」の終期とは、「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」(原告はこの時点までの乾燥を「必要な乾燥」といい、これ以降の乾燥を「余分な乾燥」として区分している。)である旨主張する(第4回弁論準備手続(技術説明会)調書参照)。
そこで検討するに、本件明細書に係る前記認定事実によれば、本件明細書の記載(【0010】、【0033】等)を踏まえると、本件発明の課題は、酢酸亜鉛水和物中の結晶水が消失して無水物に転移することを防ぐことにあり、その課題の解決手段としては、乾燥工程における品温を40℃未満とするものであると認めるのが相当である。そして、「乾燥」とは、一般的に熱を与えるなどして不要の液体分を取り除くことを意味するものであり(甲9、10)、本件明細書においても、上記と異なる意味で使用されているところはない。
そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであり、その終期とは、文字どおり、全ての乾燥が終了した時点であると解するのが相当である。
これを原告の上記主張についてみると、原告は、乾燥には「必要な乾燥」と「余分な乾燥」に区分され、「余分な乾燥」では40℃を超えることが許容される趣旨をいうものである。
しかしながら、本件発明の構成要件及び本件明細書を精査しても、原告が自認するように、「必要な乾燥」と「余分な乾燥」に区分されるという原告の解釈を裏付ける記載や示唆は一切なく、上記の間にある「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」という原告主張に係る概念も、本件発明の構成要件及び本件明細書に一切記載されておらず、それ自体明確性を欠くことに鑑みても、原告の主張は、その根拠を欠くものというほかない。
かえって、原告の主張によれば、「余分な乾燥」では40℃を超えることが許容されることになるから、乾燥工程における品温を40℃未満とする本件発明の課題解決手段に明らかに抵触するものとなり、本件明細書によれば本件発明の課題を解決できないことになる。そうすると、原告の主張は、本件発明の課題解決手段を正解しないものといえる。
したがって、原告の主張は、採用することができない。
⑵ 被告方法への当てはめ
前記認定事実によれば、被告医薬品の医薬品製造販売承認書には「乾燥終点における製品温度は《50℃》以下とする」と記載されており、被告医薬品に係る製造指図記録書においては、いずれも、品温41.0℃以上で乾燥終了との指示がされていることからすると、被告方法における「乾燥して造粒物を得る工程」では、品温が41℃以上になることが認められる。そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであるから、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を充足するものとはいえない。
したがって、被告方法は、構成要件1-1A及びC、1-3D、2-1A及びC、2-3Dを充足するものと認めることはできない。
⑶ 原告の主張に対する判断
ア 原告は、製造指図記録書(甲8)において、最初の乾燥工程で「20分」を過ぎた後に急速に品温が上昇していることからすると、この時点で少なくとも局所的には打錠用粉体とするための酢酸亜鉛水和物の造粒物を得るための「品温40℃未満」の条件下における「乾燥」が完了した旨主張する。
しかしながら、「必要な乾燥」と「余分な乾燥」に区分されるという原告の主張が採用できないことは、前記において説示したとおりである 。そうすると、原告の主張は、その前提を欠くものといえる。
イ 原告は、「整粒品製造指図記録書」(甲8)につき、平成28年5月2日の少量の治験薬に関するものであって、時期において7年以上も前のものであり、かつ、量的にもその生産量に大きく隔たりがある旨主張する。
しかしながら、証拠(甲8、乙36)及び弁論の全趣旨によれば、「整粒品製造指図記録書」の各作成日は、令和2年9月2日と同月7日であると認めるのが相当であり、原告の作成時期に係る主張は、その前提を欠く。また、令和4年10月(乙31、37)及び令和5年6月(乙38)の被告医薬品製造指図記録書には、被告医薬品1につき120万錠の製造が、被告医薬品2につき60万錠の製造が、それぞれ記録されていることからすれば、原告の生産量に係る主張も、その前提を欠くものといえる。
ウ 原告は、「製造指図記録書」(乙31)につき、令和4年10月4日頃に作成されたものかどうかが明らかではなく、仮に同日頃に作成されたものであるとしても、被告医薬品の販売が開始された10か月も前のものであるから、被告医薬品の量産品の製造条件を示すものであるかどうかが明らかではない旨主張する。
しかしながら、「製造指図記録書」(乙31-1、2)の上部には、「製品名」として被告医薬品1及び2の名称が明記されていること、被告医薬品の発売前2か月以内に実施された製造指図記録書【造粒】(乙38)においても、同様の記載が認められること、これらの製造指図記録書における乾燥条件が販売に至るまでに変更されたような事情をうかがわせる証拠はないこと、以上の事情を踏まえると、原告の主張は、前記判断を左右するものとはいえない。
エ 原告は、被告医薬品の製造販売承認書(乙19)の記載は、被告医薬品の実際の製造方法において加熱の終点が「50℃」付近でされていることを示すものではない旨主張する。
しかしながら、前記認定に係る被告方法の乾燥条件は、製造販売承認書のみをもって認定するものではなく、乾燥条件が具体的に記載されている製造指図記録書その他の証拠及び弁論の全趣旨を踏まえ、これを認定するものである。そうすると、原告の主張は、前記認定を直ちに左右するものとはいえない。
オ 原告は、「試験結果報告書」(乙11、20)につき、それぞれ被告医薬品との関連性が不明であるなどと主張する。
しかしながら、上記「試験結果報告書」は、結晶水の脱離時期や平衡含水率に達する品温を立証趣旨として、被告方法によっても無水物化等が生じないという被告の主張を裏付けるために実施された試験を報告するものである。そうすると、仮に上記試験における方法が被告方法と完全に同一ではなかったとしても、被告方法の乾燥工程における品温が40℃を超えるという認定を直ちに左右するものとはいえない。
カ 原告は、本件明細書の記載及び訴外日医工株式会社の公開特許公報の「比較例4」に係る記載(甲11)からすれば、品温40℃以上の状態における加熱が、結晶水の消失の抑制の観点から好ましくないことは明らかである旨主張する。
しかしながら、被告医薬品に係る製造指図記録書等を踏まえると、被告方法における品温は40℃を超えていると認められることは、前記において認定したとおりであり、仮に当該状態が好ましくないとしても、原告の主張は、本件発明の構成要件充足性を左右するものとはいえない。
のみならず、甲11の公開特許公報【0032】及び【0033】によれば、原告主張に係る実施例とは、酢酸亜鉛水和物、中鎖脂肪酸トリグリセリド(MCT)、結晶セルロース、ヒドロキシプロピルセルロース及び精製水を混合したもの(実施例17)と、このうちMCT以外を混合したもの(比較例4)につき、それぞれ造粒物の温度を5℃ずつ上昇させた場合における無水物含有率を示すものであることが認められる。
しかしながら、比較例4の混合物の構成は、被告医薬品と同一ではなく、そもそも造粒物温度40℃(無水物含有率0.9%)から45℃(無水物含有率11.6%)までの間の無水物率の変化が記載されていないことからすると、原告主張に係る実施例は、本件に適切ではなく、前記認定を直ちに左右するものとはいえない。かえって、40℃から45℃にかけて無水物含有率が大幅に上昇していることからすると、本件明細書のとおり、条件次第では40℃を超える加熱でも酢酸亜鉛水和物中の結晶水が脱離する場合があることを示唆するものともいえる。
キ 原告は、被告方法の乾燥工程及び追加乾燥工程で行われる「品温40℃以上」の状態での加熱は極めて短時間であり、造粒物に与える影響はほぼ無視し得るものである旨主張する。
しかしながら、本件発明の課題は、酢酸亜鉛水和物中の結晶水が消失して無水物に転移することを防ぐことにあり、その課題の解決手段として、乾燥工程における品温を40℃未満とするものであることは、前記において説示したとおりである。そのため、仮に、被告方法の乾燥工程における「品温40℃以上」の状態での加熱が極めて短時間であったとしても、上記の課題解決手段に明らかに反するものであり、原告主張に係る事情は、構成要件充足性を肯定し得る事情にはなり得ない。
そうすると、原告の主張は、本件発明の課題解決手段を正解しないものであって、構成要件充足性に係る前記判断を左右するものではない。
ク その他に、原告の準備書面及び提出証拠を改めて検討しても、原告の主張は、その余の主張を含め、本件発明の課題解決手段を正解しないものに帰し、前記判断を左右するに至らない。
ケ 以上によれば、原告の主張は、いずれも採用することができない。
⑷ 小括
以上によれば、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件(構成要件1-1A及びC、1-3D、2-1A及びC、2-3D)を充足するものとはいえない。
・・・
第5 結論
よって、原告の請求は理由がないからこれらをいずれも棄却することとして、主文のとおり判決する。

コメント