<判決紹介>
・平成30年(ネ)第10043号 特許権侵害差止等請求控訴事件
・令和元年10月3日判決言渡
・知的財産高等裁判所第2部 森義之 眞鍋美穂子 佐野信
・控訴人:バクスアルタ インコーポレーテッド、バクスアルタ ゲーエムベーハー
・被控訴人:中外製薬株式会社
・特許4313531
・発明の名称:第IX因子/第IXa因子の抗体および抗体誘導体
抗第IXa因子抗体特許の侵害訴訟の紹介です。
東京地裁で非侵害と判断され、知財高裁へ控訴された案件です。
原判決(東京地裁)は先日のブログで紹介しています。
特許4313531の特許権を有するバクスアルタ(控訴人)が、中外製薬(被控訴人)のヘムライブラ(一般名:エミシズマブ)が本件特許発明の技術的範囲に属するとして、製造等の差し止め及び廃棄を求めた事案です。
原判決では、技術的範囲に属さないと判断し、請求を棄却しました。バクスアルタが原判決を不服として控訴し、今回の判決に至ります。
本件特許の訂正後の請求項1は以下のとおりです。
「【請求項1】
1A 第Ⅸ因子または第Ⅸa因子に対する抗体または抗体誘導体であって,
1B 凝血促進活性を増大させる,
1C 抗体または抗体誘導体(ただし,抗体クローンAHIX-5041:Haematologic Technologies社製,抗体クローンHIX-1:SIGMA-ALDRICH社製,抗体クローンESN-2:American Diagnostica社製,および抗体クローンESN-3:American Diagnostica社製,ならびにそれらの抗体誘導体を除く)。」
エミシズマブが、請求項1の「凝血促進活性を増大させる」の技術的範囲に含まれるかが争点になりました。
本件特許明細書には、「凝血促進活性を増大させるモノスペシフィック抗体」が記載されています。一方で、エミシズマブは「凝血促進活性を増大させない(但し、中外製薬(被控訴人)の主張)モノスペシフィック抗体から誘導された、凝血促進活性を増大させるバイスペシフィック抗体」という特殊な抗体です。
原判決では、エミシズマブが「凝血促進活性を増大させる」という機能を有していても、課題解決手段が異なるため、技術的範囲に含まれないと判断されていました。
今回、知財高裁はこの判断手法を採用し、同じような判断をしました。
バクスアルタ(控訴人)は、エミシズマブの改変元のモノスペシフィック抗体(Q等)が「凝血促進活性を増大させる」点を主張しました。しかし、実験結果等を根拠に、主張は認められませんでした。
裁判所の判断は以下のとおりです。
●判決-------------------------------------------------------------------------------------第3 当裁判所の判断
1 当裁判所も,控訴人らの請求は,当審において追加した請求を含め,いずれも理由がないものと判断する。その理由は,次のとおりである。
2 本件各発明の意義について
・・・
(2)本件各発明の意義
以上の本件明細書の発明の詳細な説明の記載によると,本件各発明の意義は,以下のとおりのものと認められる。
すなわち,従来の血友病Aの患者の処置は,欠如又は不足したFVIIIの不足を補うためにFVIII濃縮物の投与による補充療法であった(段落【0003】)。しかし,補充療法には,FVIIIインヒビターを生じさせる患者に対する処置が非常に困難かつ危険性を含んでおり(段落【0003】),そのような患者に対する処置としては,高用量のFVIIIを投与するなどのいくつかの治療方法が存在するが,高価である(段落【0004】,【0005】),多大な時間を必要とする(段落【0004】),重篤な副反応を伴い得る(段落【0004】),患者への負担が大きい(段落【0005】)等の問題点があった。本件各発明の目的は,FVIIIを抑制する患者についての特定の利点を有する,血液凝固障害の処置のための調製物を提供することであり(段落【0010】),これを,FIX又はFIXaに結合してFIXaの凝血促進活性を増大させる抗体又は抗体誘導体によって達成するというものである(段落【0011】)。そして,抗体又は抗体誘導体は,具体的には,FIX又はFIXaに対するモノクローナル抗体(モノスペシフィック抗体)を作製し(実施例1~3),これを色素形成アッセイ等の方法で凝血促進活性の程度を評価し(実施例4~9,14),そのモノクローナル抗体(モノスペシフィック抗体)から様々な抗体誘導体(例えば,CDR3領域由来ペプチド及びその誘導体〔実施例11,12〕,キメラ抗体〔実施例13〕,Fabフラグメント〔実施例15〕,単鎖抗体〔scFv。実施例10,16,18〕,ミニ抗体〔実施例17〕)を作製するものである。
3 被控訴人製品の構成等について
(1)被控訴人製品の構成
被控訴人製品は,原判決別紙「被告製品説明書」及び「被告製品のアミノ酸配列」記載のアミノ酸配列を有する非対称型バイスペシフィック抗体であり,抗体の中でもIgGに分類される。被控訴人製品は,二つの抗原結合部位を有し,その一方がFIXaを認識し,他方がFXを認識するものである(甲23,乙28,38,弁論の全趣旨)。
(2)被控訴人製品の効果等
被控訴人製品の開発過程において作製されたバイスペシフィック抗体のうち,最もFVIII補因子活性が高かった抗体は,XB12/SB04であるが,このFVIII補因子活性は,抗FIXaのモノスペシフィック抗体とは乏しい相関しか有しておらず,バイスペシフィック抗体のFVIII補因子活性は,抗FIXa抗体由来の構造だけでなく,抗FX抗体由来の構造にも影響を受けることが明らかになっている(乙55,75)。
そして,被控訴人製品は,FIXaとFXの双方に結合し,FIXaとFXとの空間的な配向を好適な状況に制御し,酵素の活性部位と基質とを正確に接触しやすくすることで,FVIII補因子活性を代替するという機序により,凝血促進活性を増大させるものである(甲165,乙33,75,121)。その増大の程度は,本件明細書の実施例と同様の手法で作製された抗体(198A1,198B3,224F3)と比較して,優れた効果をもたらしている(乙6,36によると,約1000倍の効果とされている。)。
4 争点1(被控訴人製品は本件各発明の技術的範囲に属するか)について
(1)ア 本件特許請求の範囲の請求項1(本件発明1に係る特許請求の範囲)の記載は,「第IX因子または第IXa因子に対する抗体または抗体誘導体であって,凝血促進活性を増大させる,抗体または抗体誘導体(ただし,抗体クローンAHIX-5041:Haematologic Technologies社製,抗体クローンHIX-1:SIGMA-ALDRICH社製,抗体クローンESN-2:American Diagnostica社製,および抗体クローンESN-3:American Diagnostica社製,ならびにそれらの抗体誘導体を除く)。」であり,請求項4(本件発明4に係る特許請求の範囲)は請求項1を引用している。ここで,「凝血促進活性を増大させる」との記載の意義については,本件明細書においてこれを定義した記載はない上,「血液凝固障害の処置のための調製物を提供する」(段落【0010】)という本件各発明の目的そのものであり,かつ,本件各発明における抗体又は抗体誘導体の機能又は作用を表現しているのみであって,本件各発明の目的又は効果を達成するために必要な具体的構成を明らかにしているものではない。
特許権に基づく独占権は,新規で進歩性のある特許発明を公衆に対して開示することの代償として与えられるものであるから,このように特許請求の範囲の記載が機能的,抽象的な表現にとどまっている場合に,当該機能や作用効果を果たし得る構成全てを,その技術的範囲に含まれると解することは,明細書に開示されていない技術思想に属する構成までを特許発明の技術的範囲に含めて特許権に基づく独占権を与えることになりかねないが,そのような解釈は,発明の開示の代償として独占権を付与したという特許制度の趣旨に反することになり許されないというべきである。
したがって,特許請求の範囲が上記のように抽象的,機能的な表現で記載されている場合においては,その記載のみによって発明の技術的範囲を明らかにすることはできず,上記記載に加えて明細書及び図面の記載を参酌し,そこに開示された具体的な構成に示されている技術思想に基づいて当該発明の技術的範囲を確定すべきである。もっとも,このことは,特許発明の技術的範囲を具体的な実施例に限定するものではなく,明細書及び図面の記載から当業者が理解することができ,実施することができるのであれば,同構成はその技術的範囲に含まれるものと解すべきである。
イ そこで,本件明細書において開示された具体的構成に示されている技術思想について検討する。
(ア)ある抗体が,FIX又はFIXaに結合し,FIXaの凝血促進活性を増加するか又はFVIII様活性を有することを示すための試験方法としては,凝血試験や色素形成試験等があり,これらによって評価が可能である(段落【0013】,【0014】,【0037】,【0065】)。そして,FIXaに対する抗体をスクリーニングし,色素形成アッセイによってFVIII様活性を有するモノクローナル抗体(モノスペシフィック抗体)が複数作製されており(実施例4,9),その中でFVIIIインヒビターを有する血漿の凝血をもたらす抗体(193/AD3)も確認されている(実施例7)。したがって,当業者は,FIXaに対する抗体をスクリーニングすることにより,過度の試行錯誤を要することなく,一定の割合で凝血促進活性を増大させるモノクローナル抗体(モノスペシフィック抗体)を作製できたと認められる。
また,凝血促進活性を増大させるモノクローナル抗体(モノスペシフィック抗体)からの誘導体も複数作製されているから(例えば,CDR3領域由来ペプチド及びその誘導体〔実施例11,12〕,キメラ抗体〔実施例13〕,Fabフラグメント〔実施例15〕,単鎖抗体〔scFv。実施例10,16,18〕,ミニ抗体〔実施例17〕),当業者は,凝血促進活性を増大させるモノクローナル抗体(モノスペシフィック抗体)からの誘導体も作製できたと認められる。
(イ)バイスペシフィック抗体については,本件明細書において,実施例と
して作製された例は記載されておらず,FIX又はFIXaに結合するアーム以外のアームが結合する対象の抗原がいかなるものかも開示されていない。
しかし,バイスペシフィック抗体は,抗体誘導体の一態様として明記されている(段落【0019】及び【0026】)。そして,バイスペシフィック抗体ではないものの,凝血促進活性を増大させるモノスペシフィック抗体からの誘導体も複数作製されている(実施例10~13,15~18)。
また,FIX又はFIXaに対するバイスペシフィック抗体の作製法は,本件出願日当時に複数知られており,その中でも,クワドローマ技術は簡便な方法であり,本件出願日当時の当業者にとって,合理的な時間及び努力の範囲内でバイスペシフィック抗体を作製できる手法であったのであり,また,バイスペシフィック抗体を産生するクワドローマを融合し及び選択する種々の方法及びプロトコルは,1999年において,利用可能であり,良好に確立され,二重特異性のIgG分子を作製するのに幅広く用いられていた(本件明細書の段落【0026】,甲97,100~104,甲140の1)のであるから,当業者は,本件出願日の技術常識から,FIX又はFIXaに対するバイスペシフィック抗体を作製可能であったと認められる。
さらに,前記3(2)のとおり,バイスペシフィック抗体のFVIII補因子活性と抗FIXのモノスペシフィック抗体とは乏しい相関関係しかなく,バイスペシフィック抗体のFVIII補因子活性は,抗FIX抗体由来の構造だけなく,抗FX抗体由来の構造にも影響を受けるのであるが,バイスペシフィック抗体においては,FIX又はFIXaに対する結合部位は1価になるものの,1価でも凝血促進活性を増大させる効果があり(本件明細書実施例10~12,15,16,18),バイスペシフィック抗体の二つの抗原間で立体干渉が生じない限り,モノスペシフィック抗体の活性は維持される(甲140の1)。FIX又はFIXa以外の結合部位がFXである場合を想定すると,本件出願日当時,FIXaとFXaの構造が明らかとなっており,FIXaとFXaの立体構造からすると,当業者は,FIXaとFXに結合するバイスペシフィック抗体(被控訴人が主張する非対称型バイスペシフィック抗体)で,FIXa結合部位の活性に対する干渉は起こりにくいと予測できる(甲140の1)。
したがって,当業者は,バイスペシフィック抗体(被控訴人が主張する非対称型バイスペシフィック抗体)が,モノスペシフィック抗体が有する凝血促進活性を増大させる作用を維持できると予測できたと認められる。そうすると,バイスペシフィック抗体(被控訴人が主張する非対称型バイスペシフィック抗体)についても,モノスペシフィック抗体の活性を維持しつつ当該抗体を改変した抗体誘導体の一態様として「抗体誘導体」に含まれると解される。
(ウ)以上によると,本件各発明の技術的範囲に含まれるというためには,「第IXa因子の凝血促進活性を実質的に増大させる第IX因子又は第IXa因子に対するモノクローナル抗体(モノスペシフィック抗体)又はその活性を維持しつつ当該抗体を改変した抗体誘導体」であることが必要であるものの,バイスペシフィック抗体(被控訴人が主張する非対称型バイスペシフィック抗体)は「抗体誘導体」の一態様としてこれに含まれ得ると解すべきである。
もっとも,FIX又はFIXaに対するモノクローナル抗体(モノスペシフィック抗体)がFIXaの凝血促進活性を実質的に増大させるものでない場合には,別異に解すべきである。すなわち,本件各発明の技術的範囲に属するというためには,「第IXa因子の凝血促進活性を実質的に増大させる第IX因子又は第IXa因子に対するモノクローナル抗体(モノスペシフィック抗体)又はその活性を維持しつつ当該抗体を改変した抗体誘導体」であることが必要であると解されるところ,これには,FIXaの凝血促進活性を実質的に増大させるものではないFIX又はFIXaに対するモノクローナル抗体(モノスペシフィック抗体)は含まれないし,このようなモノクローナル抗体(モノスペシフィック抗体)から誘導される抗体誘導体(バイスペシフィック抗体もこれに含まれる。)も含まれないというべきである。このような抗体誘導体(バイスペシフィック抗体)は,たとえ,それ自体がFIXaの凝血促進活性を増大させる効果を有するものであったとしても,本件各発明の課題解決手段とは異なる手段によって凝血促進活性を増大させる効果がもたらされているのであって,本件明細書の記載に基づいて当業者が理解し,実施できるものとはいえないというべきである。
(エ)被控訴人は,①非対称型バイスペシフィック抗体の著しく高い活性は,一つの分子が2種類のアームを有するというバイスペシフィック抗体に固有の機序によって初めて実現されたもので,非対称型バイスペシフィック抗体は,本件明細書においてハイブリドーマ方法によって得られたモノスペシフィック抗体とは活性及び機序の点で大きく異なっており,本件各発明の課題解決手段とは異なる手段によって凝血促進活性を増大させる効果がもたされていることになる,②FVIII補因子活性は,抗FX腕によって影響を受けるため,抗FIX(a)腕及び抗FX腕の何れの組合せが非対称型バイスペシフィック抗体のFVIII補因子活性を発現するのか,予測することが困難である,③現時点においてすら,非対称型バイスペシフィック抗体の適切な評価手法が確立できていないことなどからすると,本件明細書は,非対称型バイスペシフィック抗体を想定していなかったといえると主張する。
しかし,バイスペシフィック抗体(被控訴人が主張する非対称型バイスペシフィック抗体)が抗体誘導体の一態様として「抗体誘導体」に含まれ得ることは,既に判示したとおりであって,このことは,被控訴人が主張する非対称型バイスペシフィック抗体の凝血促進活性を増大させる効果が大きいことや,抗FIX(a)腕と抗FX腕の何れの組合せが効果があるかを予測することが困難であることや現時点において,非対称型バイスペシフィック抗体の適切な評価方法が確立していないことによって左右されるものではない。
(オ)本件明細書においては,凝血促進活性を図る方法について,2時間のインキュベーション後のFVIIIアッセイ(例えば,COATEST(登録商標)アッセイまたはイムノクロム(Immunochrom)試験)において少なくとも3のバックグラウンドの対測定値の比を示すとされている(段落【0013】,【0014】。なお,「バックグラウンドの対測定値の比」は,「ネガティブコントロールとの比」と同義である。)が,色素形成アッセイ以外にも凝固アッセイなどFVIII活性を決定するために使用される全ての方法が使用でき(段落【0037】,【0065】),同じ色素形成アッセイであってもインキュベーション時間が2時間ではない例も記載されている(実施例2,4,5,実施例11・図18~22,実施例15~18)。
このように,本件明細書に記載された凝血促進活性の評価方法は,複数存在しており,一般に,評価方法が異なればその基準が同一であるとは限らないとはいえるものの,本件明細書では,段落【0013】及び【0014】に前記2(1)クのとおり記載され,色素形成アッセイにおけるネガティブコントロールとの比が,1.7程度(例えば,段落【0081】・図11において,198/AP1はネガティブコントロールとの比が1.7程度であるが,凝血促進活性を示さないとされている。段落【0067】・図7A(196/AF235μMPefablocXa〔登録商標〕),段落【0068】・図7B(198/AM135μMPefablocXa〔登録商標〕)も同様。)や2程度(段落【0105】・図20において,A1/5はネガティブコントロールとの比が2程度であるが,有意な凝血促進活性はないと評価されている。)の場合においては,「凝血促進活性を増大させる」とは評価されていない。
本件明細書のこれらの記載に加え,前記アのような本件各発明の請求項の記載を考慮すると,当業者は,本件各発明の範囲に含まれる抗体又はその誘導体は,複数の評価方法のうち,色素形成アッセイ(FVIIIアッセイ)を実施した場合には,少なくとも3のバックグラウンドの対測定値の比(ネガティブコントロールとの比)を示すものが本件各発明の抗体及び抗体誘導体であると理解すると認められるから,「凝血促進活性を増大させる」とは,色素形成アッセイを実施した場合には,ネガティブコントロールとの比が3を超えることを意味すると認めるのが相当である。
これに対し,控訴人らは,「凝血促進活性を増大させる」について,当業者は,ネガティブコントロールとの比が1を超えるものであるか否かで判断する旨主張し,本件明細書の段落【0013】の記載は,「最終的に生成された物の評価をする際に何らかの値を決めておく必要があるので,とりあえず3としたという程度の意味である」(甲131の3頁),「任意に設定された仮の基準であり,すべての候補物質に適応すべき必須の条件ではない」(甲132の3頁),「ノイズや測定誤差の大きさに関する記載がない以上,統計学的議論から根拠をもった基準として3を導くことはできない」(甲136の1頁)などの意見書を提出するが,これらの意見書によると,本件各発明の技術的範囲が当業者にとって明らかでないことになるから,これらの意見書の意見や控訴人らの主張を採用することはできないことは,既に判示したとおりである。
・・・
ウ 以上によると,本件各発明の技術的範囲に含まれるというためには,「第IXa因子の凝血促進活性を実質的に増大させる第IX因子又は第IXa因子に対するモノクローナル抗体(モノスペシフィック抗体)又はその活性を維持しつつ当該抗体を改変した抗体誘導体」であり,インキュベーション時間を2時間とする色素形成アッセイにおけるネガティブコントロールとの比が3を超えるものを意味すると認めるのが相当である。
(3)被控訴人製品の本件各発明の属否について
ア 証拠(甲164,224,甲224の2,甲230,甲232の1,甲234の1~3,甲235の1・2,甲250,乙38)及び弁論の全趣旨によると,①控訴人らは,ⓐテクノクロム(ヒトFIXaとウシFXを含む。)にヒトFXを添加して,MonoBMの経時的な吸光度変化を120分間のインキュベーションの後のサブサンプリング法により測定した実験(2017年6月2日実施,甲164),ⓑテクノクロムを用いて,MonoBMについて,5分間及び120分間の各インキュベーション時間で,サブサンプリング法によりFVIII活性を測定した実験(2016年12月2日~2018年6月7日に実施,甲224及び甲224の2,甲224実験),Ⓒテクノクロムを用いて,MonoBM,MonoBM(CHO),Qシミラー及びQシミラー(CHO)について,それぞれ5分間及び120分間の各インキュベーション時間でサブサンプリング法によりFVIII活性を測定した実験(1回目は2018年10月22日~同月23日に実施,2回目は同年11月6日に実施,甲230及び250)をそれぞれ実施したこと,②被控訴人は,テクノクロムを用いて,Qについて,2時間のインキュベーション時間でサブサンプリング法によりFVIII活性を測定した実験を行ったこと(乙38実験),③MonoBMは,被控訴人製品の抗FIXa腕のアミノ酸配列に基づき,HEK細胞を用いて産出した抗FIXaのモノスペシフィック抗体(Fc領域は野生型IgG4を含む。),MonoBM(CHO)は,被控訴人製品の抗FIXa腕のアミノ酸配列に基づき,CHO細胞を用いて産出した抗FIXaのモノスペシフィック抗体(Fc領域は野生型IgG4を含む。),Qは,被控訴人製品のアミノ酸配列に基づき,抗FIXa側H鎖及びL鎖を使用し,HEK細胞を用いて産出したモノスペシフィック抗体,Qシミラーは,被控訴人製品の抗FIXa腕のアミノ酸配列に基づき,HEK細胞を用いて産出した抗FIXaのモノスペシフィック抗体(Fc領域はEmicizumabの抗FIXa側H鎖の元配列を有している。),Qシミラー(CHO)は,被控訴人製品の抗FIXa腕のアミノ酸配列に基づき,CHO細胞を用いて産出した抗FIXaのモノスペシフィック抗体(Fc領域はEmicizumabの抗FIXa側H鎖の元配列を有している。)であること,④上記①,②の実験結果は次のとおり(なお,インキュベーション時間120分の実験結果については,発色時間2分の値を記載しているが,インキュベーション時間5分の実験結果については,原則どおり発色時間1分の値を記載している。)であることが認められる。

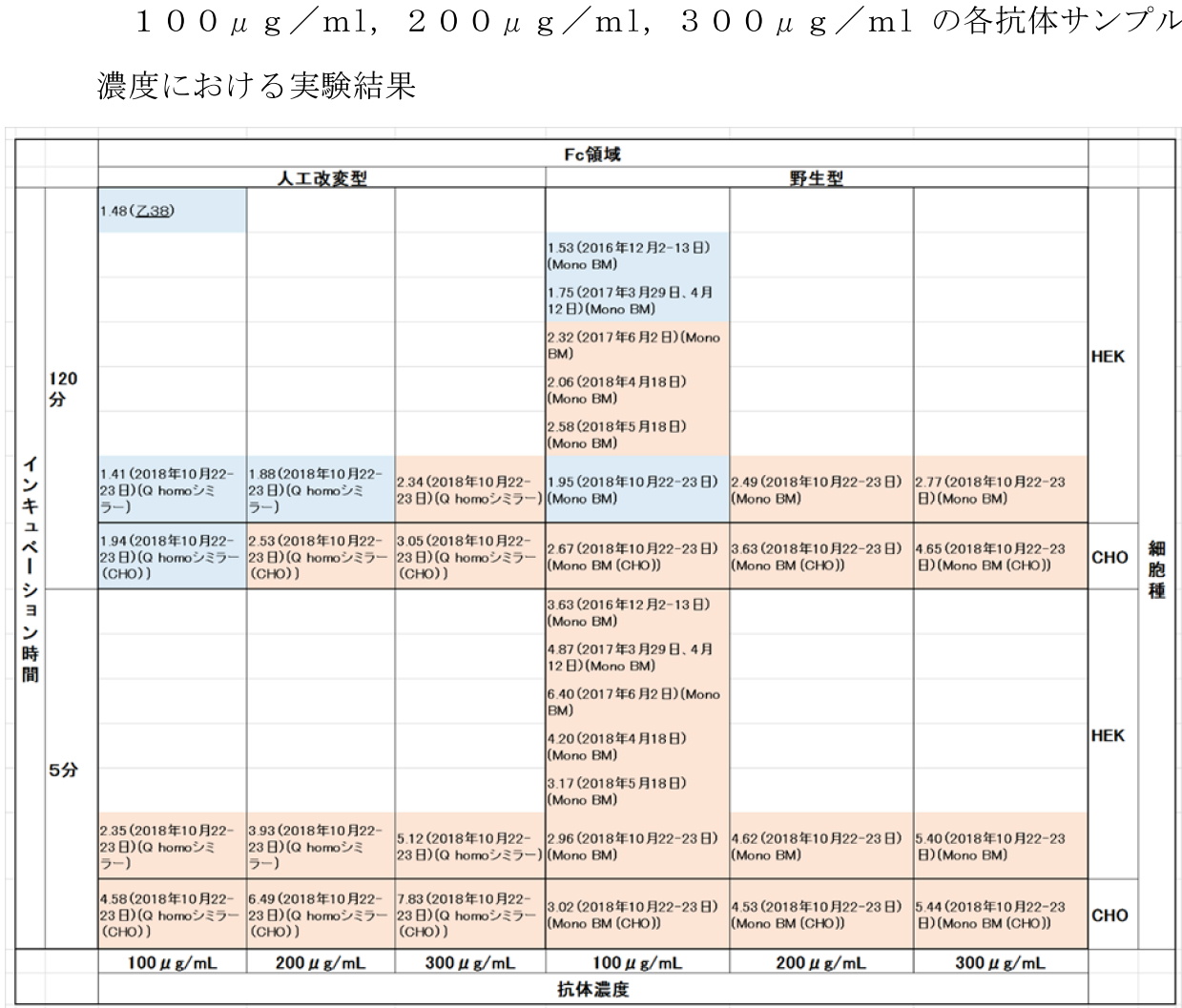
イ 証拠(甲113,甲232の1,甲234の1)及び弁論の全趣旨によると,①MonoBMとQは,Fc領域のアミノ配列の一部には違いがあるものの,抗FIX(a)腕の可変領域のアミノ酸配列に同一性があったこと,②MonoBM(CHO)とQの抗FIX(a)腕にもアミノ酸配列に上記①と同様の同一性があったこと,③Qと,Qシミラー及びQシミラー(CHO)は,アミノ酸配列が全て同一であったことが認められる。
そして,前記アの各実験結果のうち,インキュベーション時間を5分間とするものは,本件各発明の技術的範囲に含まれる抗体又は抗体誘導体の凝血促進活性を評価する場合の測定方法に合致しないため,インキュベーション時間を2時間とする実験結果のみが考慮の対象となるところ,Q,Qシミラー及びQシミラー(CHO)のネガティブコントロールとの比の値は,おおむね3以下であり,最も高くても3.05である。これに対し,MonoBM及びMonoBM(CHO)の値は4を超えるものがあるなど大きく異なっている。このことに,証拠(乙79,80,乙120の1,乙125~132)及び弁論の全趣旨によると,シグナルペプチドの配列によっては,シグナルペプチドが目的とする位置でN末端から切断されず,抗体のN末端の配列は,本来の配列から伸長又は短縮され,目的のものとは異なり,抗原結合活性や物性に影響を及ぼすことがあること,また,同一のアミノ酸配列で構成された抗体であっても,精製方法によっては,凝集物の生成及び構造変化が促進されることがあるとされており,一般に,バイオ医薬品においては,バイオ医薬品の複雑な分子構造と特有な製造プロセスのため,バイオシミラー(バイオ後続品。既に認可された先発バイオ医薬品と,直接あるいは一対一比較により品質特性,有効性,安全性の観点から類似性を示すことにより先発品と類似した製品)と先発医薬品との同一性を担保することが困難とされていることが認められることも併せて考慮すると,一部に値が3を上回っているものがあるとしても,多くの場合において,値が3を下回っている前記実験結果に基づき,被控訴人製品が本件各発明の技術的範囲に属すると認めることはできない。
ウ(ア)控訴人らは,被控訴人が行った乙36の実験において,Qは,ブランクと比較して,Km(ミカエリス・メンテン定数)が低値,kcat(酵素反応速度定数)が高値,kcat/Km(酵素反応効率)が高値,すなわち,基質(FX)に対する親和性が高く,生成速度が速く,酵素反応効率が高いことが示されていることから,Qは,FIXa(酵素)の凝血促進活性を増大させるものであると主張する。
乙36は,被控訴人製品及びQ等について,FIXaによるFX活性化反応における酵素反応速度論解析を行った実験結果であるが,本件明細書には,「凝血促進活性を増大させる」と評価するための指標として,酵素反応速度論的解析は挙げられていない上,凝血促進活性の増大と酵素反応速度論解析との関係は記載も示唆もされていないから,これらの値をもって,本件各発明にいう「凝血促進活性
を増大させる」と直ちに評価することはできない。しかも,基質に対する親和性,生成速度,酵素反応効率がどの程度向上すれば,「凝血促進活性を増大させる」と評価できるのかについての技術常識は何ら示されていない。むしろ,乙36の実験では,Q存在下での酵素反応効率は,FVIIIaの数値の0.0044%にすぎないのであるから,同実験結果をもって,Qが「凝血促進活性を増大させる」抗体であると認めることはできず,被控訴人製品が本件各発明の技術的範囲に属すると認めることはできない。
・・・
第4 結論
前記第3によると,控訴人らの請求は,その余の点を判断するまでもなく,理由がないことになる。
よって,本件控訴を棄却するとともに,控訴人らが当審において追加した請求を棄却することとして,主文のとおり判決する。
------------------------------------------------------------------------------------------
地裁に引き続きですが、課題解決手段が異なるから技術的範囲外っていうのは、かなりインパクトのある判断です。
とはいっても、クレームとイ号製品が結構特殊なのと、判決文の内容を考慮すると、他のケースへの適用はそう簡単ではないと思います。また、課題解決手段の設定基準が定まってないので、他のケースに適用した場合は、今回とは違って課題解決手段に何を設定するかという点も争いになり得ると思います。
いずれにしろ、機能限定のある抗体特許の非侵害を主張する際には、この枠組みが使えないか要検討ですね。
コメント