・令和3年3月25日判決言渡
・知的財産高等裁判所第2部 森義之 眞鍋美穂子 熊谷大輔
・原告:東レ株式会社
・被告:沢井製薬株式会社、ニプロ株式会社
・特許3531170
・発明の名称:止痒剤
本件は、特許権存続期間の延長登録の無効審決の審決取消訴訟です。
原告の東レは、レミッチ®OD錠(一般名:ナルフラフィン塩酸塩)の用途特許である特許3531170の特許権者です。本件特許は延長登録がされており、延長後の満了日は2022年11月21日です。
請求項1と、延長登録の理由となる処分は以下の通りです。
【請求項1】
下記一般式(I)
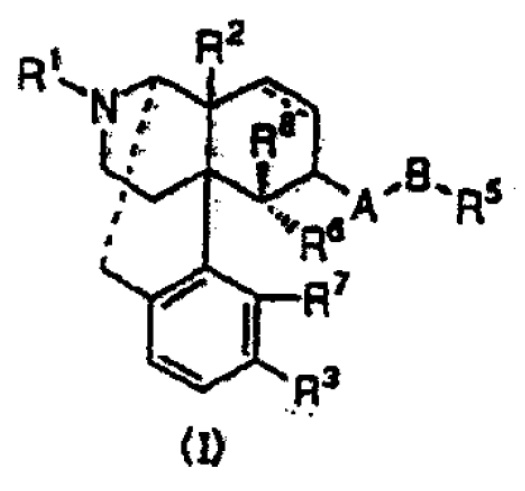
[式中,
・・・(省略)
を表し,R8は水素,炭素数1から5のアルキルまたは炭素数1から5のアルカノイルを表す。また,一般式(I)は(+)体,(-)体,(±)体を含む]で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤。
下記一般式(I)

[式中,
・・・(省略)
を表し,R8は水素,炭素数1から5のアルキルまたは炭素数1から5のアルカノイルを表す。また,一般式(I)は(+)体,(-)体,(±)体を含む]で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤。
ア 延長を求める期間 5年
イ 延長登録の理由となる処分
薬機法14条9項に規定する医薬品に係る同項の承認
ウ 処分を特定する番号 22900AMX00538000
エ 処分を受けた日 平成29年9月22日
オ 処分の対象となった医薬品
販売名 レミッチOD錠2.5μg
有効成分 ナルフラフィン塩酸塩
カ 処分の対象となった医薬品について特定された用途
(補正後)次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
透析患者(血液透析患者を除く),慢性肝疾患患者
沢井製薬(被告)が延長登録の無効審判を請求していて、令和2年7月28日に特許庁から無効審決が出ていました。イ 延長登録の理由となる処分
薬機法14条9項に規定する医薬品に係る同項の承認
ウ 処分を特定する番号 22900AMX00538000
エ 処分を受けた日 平成29年9月22日
オ 処分の対象となった医薬品
販売名 レミッチOD錠2.5μg
有効成分 ナルフラフィン塩酸塩
カ 処分の対象となった医薬品について特定された用途
(補正後)次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
透析患者(血液透析患者を除く),慢性肝疾患患者
今回、東レが審決取消訴訟を提起し、知財高裁から判決が出ました。
本件訴訟の争点は、以下の通りです。
①被告ニプロに被告適格があるか否か。
②特許3531170を実施するために、本件処分を受けることが必要であったか否か。
③延長登録の一部について無効理由があった場合に、当該延長登録の一部のみを無効にすることができるか否か。
このうち、争点②では「有効成分」の解釈が問題になっています。争点②に関する裁判所の判断の抜粋を以下に記載します。(争点①、③は本記事では省略します。)
判決
第4 当裁判所の判断
・・・
3 取消事由1(本件医薬品の有効成分に関する事実認定の誤り)について
・・・
オ 「有効成分」という用語についての当業者の理解を推認させる事情
当業者が,「有効成分」についてどのように理解しているのかを推認させるものとして,以下のような各種文献の記載がある。
(ア)薬科学大辞典編集委員会編「廣川薬科学大辞典 第5版」廣川書店,平成25年(甲65)
「有効成分[医薬品の] 単体又は1種類以上の他の成分と組み合わせ,1つの医薬品の意図された作用を起こす物質。また,成分の中で薬効を示す成分,例えば生薬の薬効をもつ成分をいうことが多く,生薬中の有効成分の分離は新薬開発の一方法。」
(イ)塩路雄作「続・医薬品工業と粉体工学」粉体工学研究会誌14巻7号409頁,昭和52年(甲66)
「医薬品の有効性とは治療効果であり,治療効果は医療品の臨床試験結果より評価されるのが通常であるが,臨床試験の前段階として,製剤より有効成分がどの程度生体内へ利用されているかを測定する必要がある。・・・・この生体への医薬品有効成分の利用率をBioavailabilityと称し,通常は投薬後一定時間おきに血液や尿を採取し,血清中や尿中に存在する(吸収され, 代謝をうけ, また排泄された)有効成分の含量の時間的推移をしらべることにより測定され,いろいろのパラメーターを用いて,もっとも吸収されやすい形で投与した場合(一般には,水溶液)や他の剤形との相対的比較で評価される。」
(ウ)石崎高志ほか「3.新薬の開発と臨床薬理」ファルマシアレビューNo.1 39頁,昭和53年(甲67)
「米国FDAの定義では,「生物学的利用能とは,活性を有する薬物成分あるいは治療有効成分が医薬品製剤から吸収され,薬の作用部位で利用されるようになる速さや量である」とされている。具体的には,有効成分の血中濃度,尿中排泄あるいは薬理効果を測定することが定められている・・・」
(エ)緒方宏泰「先発医薬品と臨床上の有効性・安全性が『同等』であるジェネリック医薬品の評価~生物学的同等性を考える~」後発医薬品品質情報No.2 3頁~4頁,平成26年(甲73)
「製剤中に含まれている有効成分は,投与された後に,製剤から放出あるいは溶出される必要があります。そのため,試験管内での放出速度や溶出速度を比較検討することで,それら製剤を投与後の有効成分の血中濃度や作用発現部位中の濃度は推定でき,ヒト試験の代わりになるのではと期待される面があります。」
(オ)井上勝央「医薬品の吸収機構の解明とその吸収性改善・予測への応用を目指して」Tokyo University of Pharmacy and Life Sciences 124号 5頁,平成28年(甲74)
「飲み薬は,きちっと服用すれば,有効成分がすべて腸で吸収されて,すべて全身を巡る。」
(カ)その他,佐久間昭「薬の効果・逆効果 臨床薬理学入門」講談社 21頁,昭和56年(甲68)及び當瀬規嗣「よくわかる薬理学の基本としくみ」秀和システム 43頁,平成20年(甲71)並びに賀川義之「飲み方守って効果発揮」静岡新聞夕刊5頁,平成25年(甲72)には,人体内部で血液中に取り込まれるのが「有効成分」であるとする趣旨の記載がある。
カ ナルフラフィン塩酸塩を含む医薬品について記載した各種の文献の記載
ナルフラフィン塩酸塩を含む本件医薬品及び本件カプセル製剤について記載した各種の文献では,「有効成分であるナルフラフィン」(甲93[成川衛「革新的医薬品 審査のポイント」日経BP社 338頁~341頁,平成27年]),「ナルフラフィン2.5μg」,「ナルフラフィン5μg」,「ナルフラフィン10μg」(甲94[熊谷裕生ほか「新しいかゆみ治療薬ナルフラフィン(レミッチ)の臨床開発と有効性」透析療法ネクストⅫ 94頁~108頁,平成23年],甲95[熊谷裕生ほか「血液透析患者のかゆみの病態生理とナルフラフィンの臨床効果」週刊日本医事新報4538号72頁~80頁,平成23年],甲96[熊谷裕生ほか「血液透析患者のかゆみの病態とナルフラフィンの効果」モダンフィジシャン32巻4号 442頁~445頁,平成24年],甲97[深川雅史ほか「EBM透析療法」中外医学社 232頁,平成22年]),「レミッチOD錠2.5μg 成分(・・・)ナルフラフィン(2.5μg/錠)」(甲102[大館市立総合病院薬剤科「薬局ニュース」28巻4号,平成29年])などとして,ナルフラフィン塩酸塩とナルフラフィンを必ずしも区別することなく記載している例がある。
キ 薬事行政における「有効成分」の取扱い等
(ア)厚生省薬務局が編纂した「逐条解説 薬事法」(ぎょうせい,昭和58年)は,平成18年法律第69号による改正前の薬事法50条7号(薬機法50条10号)に記載された「有効成分」の解釈について,「『有効成分』とは,医薬品の目的たる効能,効果を薬理的に生ぜしめる有効な成分を意味する。したがって,効能,効果と直接の関係のない賦形剤,安定剤,溶剤等の製剤補助剤は含まれない。」
と記載している(甲31)。
(イ)厚生省薬務局審査第一課長及び生物製剤課長が,各都道府県衛生主管部(局)長あてに,昭和63年3月11日付けで通知した,承認申請の目的で実施される徐放性製剤(経口投与製剤)の設計及び評価に関するガイドラインである「徐放性製剤(経口投与製剤)の設計及び評価に関するガイドライン」(薬審―第五号)には,以下のような記載がある(甲76)。
「医薬品の徐放化は有効成分の血中濃度を適正水準に維持することに主要な意義がある。従つて,薬物あるいは活性代謝物を含めた有効成分の血中濃度と薬効との関係について検討し,平均的な最低有効濃度,最適治療濃度等を明らかにしておくことが望ましい。」
「原則として健康人を対象とし,速放性製剤あるいは原薬と比較し,当該製剤の薬物速度論的特性を評価すること。薬物速度論的評価は,作用部位における有効成分の濃度測定が可能で,且つその有効濃度が明らかになっている場合を除いて,原則として血液データに基づいて行う。尿,唾液等の血液以外の体液データは,有効成分の作用部位濃度または血中濃度とそれらの体液中濃度との間に関連性が認められる場合に用いることができる。」
ク 専門家の意見書
D名誉教授,神戸学院大学薬学部のE教授及び熊本大学薬学部のF教授は,本件医薬品や本件カプセル製剤について,フリー体であるナルフラフィンが「有効成分」であると鑑定意見書(甲29,30,106)に記載している。
D名誉教授は,D意見書(甲106)において,「医薬品における「有効成分」とは,消化管から吸収され,循環血液に移行し,受容体などのタンパク質と結合す
ることで薬理作用を発揮する化学物質を表すことが昭和49年から現在に至るまでの技術常識です。」と記載している。
(2)検討
前記(1)で認定した事実関係をもとにして,本件発明の実施に本件処分を受けることが必要であったかどうかについて検討するが,前記第2の1のとおり,本件処分は,薬機法14条9項に基づく医薬品製造販売承認事項一部変更承認であるから,本件処分においては,前記(1)ア(ア)で認定した「有効成分」をはじめとする先行処分に係る製造販売承認書の記載に基づくものであると認められる。
ア 特許権の存続期間の延長登録の制度は,政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものであるから,本件発明の実施に本件処分を受けることが必要であったかどうかは,このような特許法の存続期間延長の制度が設けられている趣旨に照らして判断されるべきであり,その場合における本件処分の内容の認定についても,このような観点から実質的に判断されるべきであって,承認書の「有効成分」の記載内容から形式的に判断すべきではない。このように解することは,最高裁平成26年(行ヒ)第356号同27年11月17日第三小法廷判決・民集69巻7号1912頁の趣旨にも沿うものということができる。
イ 前記(1)エで認定した事実からすると,医薬品について,良好な物性と安定性の観点からフリー体に酸等が付加されて,フリー体とは異なる化合物(付加塩)が医薬品とされる場合があること,そのような医薬品が人体に取り込まれたときには,付加塩からフリー体が解離し,フリー体が薬効及び薬理作用を奏すること,ナルフラフィンとナルフラフィン塩酸塩についても同様の関係にあり,ナルフラフィンとナルフラフィン塩酸塩で薬効及び薬理作用に違いがないことは,平成28年3月31日に先行処分に係る製造販売の承認申請がされた時までに,当業者に広く知られていたものと認められる。
ウ 上記イで述べたところに,前記(1)オ,カ,キで認定した事実や前記(1) クの専門家の意見書の内容を総合すると,医薬品分野の当業者は,医薬品の目的たる効能,効果を生ぜしめる作用に着目して,医薬品に配合される付加塩だけでなく,そのフリー体も「有効成分」と捉えることがあるものと認められる。
エ 前記(1)ア~ウのとおり,先行処分に係る製造販売承認書には,「成分」として「ナルフラフィン塩酸塩」と記載されており,本件添付文書にも「有効成分に関する理化学的知見」として,「ナルフラフィン塩酸塩」と記載され,その構造式や性状などが記載されているが,これは,賦形剤などの製剤補助剤と区別する観点から,実際に医薬品に配合されている原薬(付加塩)を有効成分として捉えていることに基づく記載であると解される。これに対し,本件添付文書の「有効成分・含量(1カプセル中)」の欄に,「ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)」と記載されており,本件インタビューフォームには,和名は「ナルフラフィン塩酸塩」と記載されているものの,洋名については「ナルフラフィン塩酸塩」と「ナルフラフィン」が併記されているし,「有効成分(活性成分)の含量」として,「カプセル:1カプセル中ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)含有 OD錠:1錠中ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)含有」と記載されている。そして,前記(1)アのとおり,先行処分に係る製造販売承認書では,●●●●●同じく,前記(1)イ,ウのとおり,本件添付文書や本件インタビューフォームにおける,本件医薬品の「薬物動態」の血漿中濃度推移や薬物動態パラメータもナルフラフィン塩酸塩ではなく,ナルフラフィンを測定して得られたものとなっている。
オ 以上のことを考え併せると,本件処分の対象となった本件医薬品の有効成分は,先行処分に係る製造販売承認書に記載された「ナルフラフィン塩酸塩」と形式的に決するのではなく,実質的には,本件医薬品の承認審査において,効能,効果を生ぜしめる成分として着目されていたフリー体の「ナルフラフィン」と,本件医薬品に配合されている,その原薬形態の「ナルフラフィン塩酸塩」の双方であると認めるのが相当である。
したがって,「ナルフラフィン塩酸塩」のみを本件医薬品の有効成分と解し,「ナルフラフィン」は,本件医薬品の有効成分ではないと認定して,本件発明の実施に本件処分を受けることが必要であったとはいえないと判断した本件審決の認定判断は誤りであり,取消事由1は理由がある。
(3)被告らの主張について
被告らは,①ナルフラフィン塩酸塩が,有効成分の一般的名称(JAN)とされていること,②ナルフラフィンのフリー体とナルフラフィン塩酸塩は化学構造も異なり,「止痒剤」として使用される場面での溶解性等も異なるが,医薬品にとって溶解性等はその作用効果として重要であるから,酸付加塩の有無は,投与時における有効成分として理解されるべきであること,③本件特許との関係では,生体内における存在形態ではなく,販売される場合の有効成分の存在形態が問題とされるべきであること,④「フリー体と酸付加塩の両方で承認取得した事例」や「フリー体と酸付加塩で効能効果が違う事例」(乙1~4)が存在するなどと主張する。
ア 上記①について
前記(1)ウ(イ),(ウ)で認定したとおり,本件医薬品の「一般名」のうち,「和名」はナルフラフィン塩酸塩であるが,他方で,「洋名」のうち,国際一般的名称(INN)は,「nalfurafine」であるから,「一般名」のみで有効成分を特定することができるというものではなく,被告沢井製薬の主張するところが,前記(2)の認定判断を左右するものとはいえない
イ 上記②,③について
溶解性や安定性の向上などのために,本件医薬品の原薬形態が,ナルフラフィン塩酸塩とされていることは,前記(1)エ(エ)で認定したとおりであるが,前記(1)で認定した事実からすると,前記(2)で認定判断したとおり,投与時の原薬形態であるナルフラフィン塩酸塩のみならず,本件医薬品の承認審査で,効能,効果を生ぜしめる成分として着目されていた,ヒトに投与した後の形態であるフリー体のナルフラフィンも,本件医薬品の「有効成分」と認定すべきである。
前記2で認定したように,本件発明は,一般式(I)で示される化合物をはじめとする特定のオピオイドκ受容体作動性化合物を有効成分とした止痒剤に関する発明であり,本件発明の技術的意義が,販売される場合のオピオイドκ受容体作動性化合物の存在形態にあるものとは認められないから,そのような販売される場合の存在形態の違いによって,本件処分における本件医薬品の有効成分の認定が左右されるとは解されない。
ウ 上記④について
薬機法上,医薬品の製造販売承認において,フリー体と酸付加塩で異なる承認が得られる場合があったとしても(乙1~4),本件医薬品の処分の内容は,特許法において存続期間の延長登録制度が設けられている趣旨に照らし,特許法の観点から実質的に,認定判断されるべきものであるから,それらの事例の存在が,本件処分の内容を前記(2)のように認定することを妨げるものということはできない。
エ その他,前記(2)の認定判断に反する被告らの主張を採用することができないことは,既に判示したところから明らかである。
・・・
第5 結論
以上の次第で,取消事由1は理由があり,本件審決にはその結論に影響を及ぼす違法があるものの,本件審決が,無効理由2に基づき,本件延長登録のうち「処分の対象となった医薬品について特定された用途」を「慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」とする部分を無効にしたことは正当であるから,本件審決のうち「本件延長登録のうち『処分の対象となった医薬品について特定された用途』が『慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)』との部分は無効とする」部分以外を取り消し,その余の請求を棄却することとし,主文のとおり判決する。
・・・
3 取消事由1(本件医薬品の有効成分に関する事実認定の誤り)について
・・・
オ 「有効成分」という用語についての当業者の理解を推認させる事情
当業者が,「有効成分」についてどのように理解しているのかを推認させるものとして,以下のような各種文献の記載がある。
(ア)薬科学大辞典編集委員会編「廣川薬科学大辞典 第5版」廣川書店,平成25年(甲65)
「有効成分[医薬品の] 単体又は1種類以上の他の成分と組み合わせ,1つの医薬品の意図された作用を起こす物質。また,成分の中で薬効を示す成分,例えば生薬の薬効をもつ成分をいうことが多く,生薬中の有効成分の分離は新薬開発の一方法。」
(イ)塩路雄作「続・医薬品工業と粉体工学」粉体工学研究会誌14巻7号409頁,昭和52年(甲66)
「医薬品の有効性とは治療効果であり,治療効果は医療品の臨床試験結果より評価されるのが通常であるが,臨床試験の前段階として,製剤より有効成分がどの程度生体内へ利用されているかを測定する必要がある。・・・・この生体への医薬品有効成分の利用率をBioavailabilityと称し,通常は投薬後一定時間おきに血液や尿を採取し,血清中や尿中に存在する(吸収され, 代謝をうけ, また排泄された)有効成分の含量の時間的推移をしらべることにより測定され,いろいろのパラメーターを用いて,もっとも吸収されやすい形で投与した場合(一般には,水溶液)や他の剤形との相対的比較で評価される。」
(ウ)石崎高志ほか「3.新薬の開発と臨床薬理」ファルマシアレビューNo.1 39頁,昭和53年(甲67)
「米国FDAの定義では,「生物学的利用能とは,活性を有する薬物成分あるいは治療有効成分が医薬品製剤から吸収され,薬の作用部位で利用されるようになる速さや量である」とされている。具体的には,有効成分の血中濃度,尿中排泄あるいは薬理効果を測定することが定められている・・・」
(エ)緒方宏泰「先発医薬品と臨床上の有効性・安全性が『同等』であるジェネリック医薬品の評価~生物学的同等性を考える~」後発医薬品品質情報No.2 3頁~4頁,平成26年(甲73)
「製剤中に含まれている有効成分は,投与された後に,製剤から放出あるいは溶出される必要があります。そのため,試験管内での放出速度や溶出速度を比較検討することで,それら製剤を投与後の有効成分の血中濃度や作用発現部位中の濃度は推定でき,ヒト試験の代わりになるのではと期待される面があります。」
(オ)井上勝央「医薬品の吸収機構の解明とその吸収性改善・予測への応用を目指して」Tokyo University of Pharmacy and Life Sciences 124号 5頁,平成28年(甲74)
「飲み薬は,きちっと服用すれば,有効成分がすべて腸で吸収されて,すべて全身を巡る。」
(カ)その他,佐久間昭「薬の効果・逆効果 臨床薬理学入門」講談社 21頁,昭和56年(甲68)及び當瀬規嗣「よくわかる薬理学の基本としくみ」秀和システム 43頁,平成20年(甲71)並びに賀川義之「飲み方守って効果発揮」静岡新聞夕刊5頁,平成25年(甲72)には,人体内部で血液中に取り込まれるのが「有効成分」であるとする趣旨の記載がある。
カ ナルフラフィン塩酸塩を含む医薬品について記載した各種の文献の記載
ナルフラフィン塩酸塩を含む本件医薬品及び本件カプセル製剤について記載した各種の文献では,「有効成分であるナルフラフィン」(甲93[成川衛「革新的医薬品 審査のポイント」日経BP社 338頁~341頁,平成27年]),「ナルフラフィン2.5μg」,「ナルフラフィン5μg」,「ナルフラフィン10μg」(甲94[熊谷裕生ほか「新しいかゆみ治療薬ナルフラフィン(レミッチ)の臨床開発と有効性」透析療法ネクストⅫ 94頁~108頁,平成23年],甲95[熊谷裕生ほか「血液透析患者のかゆみの病態生理とナルフラフィンの臨床効果」週刊日本医事新報4538号72頁~80頁,平成23年],甲96[熊谷裕生ほか「血液透析患者のかゆみの病態とナルフラフィンの効果」モダンフィジシャン32巻4号 442頁~445頁,平成24年],甲97[深川雅史ほか「EBM透析療法」中外医学社 232頁,平成22年]),「レミッチOD錠2.5μg 成分(・・・)ナルフラフィン(2.5μg/錠)」(甲102[大館市立総合病院薬剤科「薬局ニュース」28巻4号,平成29年])などとして,ナルフラフィン塩酸塩とナルフラフィンを必ずしも区別することなく記載している例がある。
キ 薬事行政における「有効成分」の取扱い等
(ア)厚生省薬務局が編纂した「逐条解説 薬事法」(ぎょうせい,昭和58年)は,平成18年法律第69号による改正前の薬事法50条7号(薬機法50条10号)に記載された「有効成分」の解釈について,「『有効成分』とは,医薬品の目的たる効能,効果を薬理的に生ぜしめる有効な成分を意味する。したがって,効能,効果と直接の関係のない賦形剤,安定剤,溶剤等の製剤補助剤は含まれない。」
と記載している(甲31)。
(イ)厚生省薬務局審査第一課長及び生物製剤課長が,各都道府県衛生主管部(局)長あてに,昭和63年3月11日付けで通知した,承認申請の目的で実施される徐放性製剤(経口投与製剤)の設計及び評価に関するガイドラインである「徐放性製剤(経口投与製剤)の設計及び評価に関するガイドライン」(薬審―第五号)には,以下のような記載がある(甲76)。
「医薬品の徐放化は有効成分の血中濃度を適正水準に維持することに主要な意義がある。従つて,薬物あるいは活性代謝物を含めた有効成分の血中濃度と薬効との関係について検討し,平均的な最低有効濃度,最適治療濃度等を明らかにしておくことが望ましい。」
「原則として健康人を対象とし,速放性製剤あるいは原薬と比較し,当該製剤の薬物速度論的特性を評価すること。薬物速度論的評価は,作用部位における有効成分の濃度測定が可能で,且つその有効濃度が明らかになっている場合を除いて,原則として血液データに基づいて行う。尿,唾液等の血液以外の体液データは,有効成分の作用部位濃度または血中濃度とそれらの体液中濃度との間に関連性が認められる場合に用いることができる。」
ク 専門家の意見書
D名誉教授,神戸学院大学薬学部のE教授及び熊本大学薬学部のF教授は,本件医薬品や本件カプセル製剤について,フリー体であるナルフラフィンが「有効成分」であると鑑定意見書(甲29,30,106)に記載している。
D名誉教授は,D意見書(甲106)において,「医薬品における「有効成分」とは,消化管から吸収され,循環血液に移行し,受容体などのタンパク質と結合す
ることで薬理作用を発揮する化学物質を表すことが昭和49年から現在に至るまでの技術常識です。」と記載している。
(2)検討
前記(1)で認定した事実関係をもとにして,本件発明の実施に本件処分を受けることが必要であったかどうかについて検討するが,前記第2の1のとおり,本件処分は,薬機法14条9項に基づく医薬品製造販売承認事項一部変更承認であるから,本件処分においては,前記(1)ア(ア)で認定した「有効成分」をはじめとする先行処分に係る製造販売承認書の記載に基づくものであると認められる。
ア 特許権の存続期間の延長登録の制度は,政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものであるから,本件発明の実施に本件処分を受けることが必要であったかどうかは,このような特許法の存続期間延長の制度が設けられている趣旨に照らして判断されるべきであり,その場合における本件処分の内容の認定についても,このような観点から実質的に判断されるべきであって,承認書の「有効成分」の記載内容から形式的に判断すべきではない。このように解することは,最高裁平成26年(行ヒ)第356号同27年11月17日第三小法廷判決・民集69巻7号1912頁の趣旨にも沿うものということができる。
イ 前記(1)エで認定した事実からすると,医薬品について,良好な物性と安定性の観点からフリー体に酸等が付加されて,フリー体とは異なる化合物(付加塩)が医薬品とされる場合があること,そのような医薬品が人体に取り込まれたときには,付加塩からフリー体が解離し,フリー体が薬効及び薬理作用を奏すること,ナルフラフィンとナルフラフィン塩酸塩についても同様の関係にあり,ナルフラフィンとナルフラフィン塩酸塩で薬効及び薬理作用に違いがないことは,平成28年3月31日に先行処分に係る製造販売の承認申請がされた時までに,当業者に広く知られていたものと認められる。
ウ 上記イで述べたところに,前記(1)オ,カ,キで認定した事実や前記(1) クの専門家の意見書の内容を総合すると,医薬品分野の当業者は,医薬品の目的たる効能,効果を生ぜしめる作用に着目して,医薬品に配合される付加塩だけでなく,そのフリー体も「有効成分」と捉えることがあるものと認められる。
エ 前記(1)ア~ウのとおり,先行処分に係る製造販売承認書には,「成分」として「ナルフラフィン塩酸塩」と記載されており,本件添付文書にも「有効成分に関する理化学的知見」として,「ナルフラフィン塩酸塩」と記載され,その構造式や性状などが記載されているが,これは,賦形剤などの製剤補助剤と区別する観点から,実際に医薬品に配合されている原薬(付加塩)を有効成分として捉えていることに基づく記載であると解される。これに対し,本件添付文書の「有効成分・含量(1カプセル中)」の欄に,「ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)」と記載されており,本件インタビューフォームには,和名は「ナルフラフィン塩酸塩」と記載されているものの,洋名については「ナルフラフィン塩酸塩」と「ナルフラフィン」が併記されているし,「有効成分(活性成分)の含量」として,「カプセル:1カプセル中ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)含有 OD錠:1錠中ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)含有」と記載されている。そして,前記(1)アのとおり,先行処分に係る製造販売承認書では,●●●●●同じく,前記(1)イ,ウのとおり,本件添付文書や本件インタビューフォームにおける,本件医薬品の「薬物動態」の血漿中濃度推移や薬物動態パラメータもナルフラフィン塩酸塩ではなく,ナルフラフィンを測定して得られたものとなっている。
オ 以上のことを考え併せると,本件処分の対象となった本件医薬品の有効成分は,先行処分に係る製造販売承認書に記載された「ナルフラフィン塩酸塩」と形式的に決するのではなく,実質的には,本件医薬品の承認審査において,効能,効果を生ぜしめる成分として着目されていたフリー体の「ナルフラフィン」と,本件医薬品に配合されている,その原薬形態の「ナルフラフィン塩酸塩」の双方であると認めるのが相当である。
したがって,「ナルフラフィン塩酸塩」のみを本件医薬品の有効成分と解し,「ナルフラフィン」は,本件医薬品の有効成分ではないと認定して,本件発明の実施に本件処分を受けることが必要であったとはいえないと判断した本件審決の認定判断は誤りであり,取消事由1は理由がある。
(3)被告らの主張について
被告らは,①ナルフラフィン塩酸塩が,有効成分の一般的名称(JAN)とされていること,②ナルフラフィンのフリー体とナルフラフィン塩酸塩は化学構造も異なり,「止痒剤」として使用される場面での溶解性等も異なるが,医薬品にとって溶解性等はその作用効果として重要であるから,酸付加塩の有無は,投与時における有効成分として理解されるべきであること,③本件特許との関係では,生体内における存在形態ではなく,販売される場合の有効成分の存在形態が問題とされるべきであること,④「フリー体と酸付加塩の両方で承認取得した事例」や「フリー体と酸付加塩で効能効果が違う事例」(乙1~4)が存在するなどと主張する。
ア 上記①について
前記(1)ウ(イ),(ウ)で認定したとおり,本件医薬品の「一般名」のうち,「和名」はナルフラフィン塩酸塩であるが,他方で,「洋名」のうち,国際一般的名称(INN)は,「nalfurafine」であるから,「一般名」のみで有効成分を特定することができるというものではなく,被告沢井製薬の主張するところが,前記(2)の認定判断を左右するものとはいえない
イ 上記②,③について
溶解性や安定性の向上などのために,本件医薬品の原薬形態が,ナルフラフィン塩酸塩とされていることは,前記(1)エ(エ)で認定したとおりであるが,前記(1)で認定した事実からすると,前記(2)で認定判断したとおり,投与時の原薬形態であるナルフラフィン塩酸塩のみならず,本件医薬品の承認審査で,効能,効果を生ぜしめる成分として着目されていた,ヒトに投与した後の形態であるフリー体のナルフラフィンも,本件医薬品の「有効成分」と認定すべきである。
前記2で認定したように,本件発明は,一般式(I)で示される化合物をはじめとする特定のオピオイドκ受容体作動性化合物を有効成分とした止痒剤に関する発明であり,本件発明の技術的意義が,販売される場合のオピオイドκ受容体作動性化合物の存在形態にあるものとは認められないから,そのような販売される場合の存在形態の違いによって,本件処分における本件医薬品の有効成分の認定が左右されるとは解されない。
ウ 上記④について
薬機法上,医薬品の製造販売承認において,フリー体と酸付加塩で異なる承認が得られる場合があったとしても(乙1~4),本件医薬品の処分の内容は,特許法において存続期間の延長登録制度が設けられている趣旨に照らし,特許法の観点から実質的に,認定判断されるべきものであるから,それらの事例の存在が,本件処分の内容を前記(2)のように認定することを妨げるものということはできない。
エ その他,前記(2)の認定判断に反する被告らの主張を採用することができないことは,既に判示したところから明らかである。
・・・
第5 結論
以上の次第で,取消事由1は理由があり,本件審決にはその結論に影響を及ぼす違法があるものの,本件審決が,無効理由2に基づき,本件延長登録のうち「処分の対象となった医薬品について特定された用途」を「慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」とする部分を無効にしたことは正当であるから,本件審決のうち「本件延長登録のうち『処分の対象となった医薬品について特定された用途』が『慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)』との部分は無効とする」部分以外を取り消し,その余の請求を棄却することとし,主文のとおり判決する。
たしかに、レミッチの有効成分は何かと言われたら、「ナルフラフィン塩酸塩」も「フリー体のナルフラフィン」も答えとしてはあり得るなと思います。
この点では、判決には納得感があります。
気になったところとして、本件特許の請求項1に「・・・を有効成分とする止痒剤。」っていう表現があります。こういう場合、実務的に多い書き方としては、「・・・を含む止痒剤。」又は「・・・を含有する止痒剤。」だと思います。特に、不要な限定は避けたいので「有効成分」は書かない方がよいという見方もあると思います。
ただ、この判決を見てから改めて考えてみると、「有効成分とする」にも良い点が見えてきます。
「Xを有効成分とする○剤」と表現すると、仮に製剤中にX(例:フリー体のX)が含有されていなくても、添付文書等の記載から製剤の有効成分がXであると解釈できるのであれば、その製剤は特許の範囲に含まれると解釈できる余地がでてくるように思います。
そういう視点でみると、「有効成分とする」もありですね。
・・・と書いたところでこの記事をアップしようとしたのですが、改めてネットを確認してみると、「有効成分とする」の論点について、そーとく先生のブログ(リンク)ですでに議論されていました。
また、Fubuki先生のブログ(リンク)では、本記事で紹介していない本件訴訟の論点についても解説されています。その他、本件訴訟含め、本件特許に関連する延長登録関連の審決取消訴訟4件、特許維持審決の審決取消訴訟1件、侵害訴訟(地裁)1件も詳細に解説されています。
大変勉強になります。
侵害訴訟(地裁)については、近日中に紹介記事をアップ予定です。
(判決文PDFはこちら)

コメント