■コメント: アリセプト®(塩酸ドネペジル)の期間延長に関する判決。 延長登録の理由となった処分の対象となった物について特定された用途について、「軽度及び中等度のアルツハイマー型痴呆における痴呆症状の進行抑制」とした延長登録が平成13年12月19日になされている(2年11月12日の期間延長)。 そのような中、処分の対象となった物について特定された用途について、「アルツハイマー型認知症における認知症症状の進行抑制(但し,軽度及び中程度のアルツハイマー型認知症における認知症症状の進行抑制を除く。)」とした延長登録が認められるかが問われた。
争点は、「軽度及び中等度のアルツハイマー型痴呆における痴呆症状の進行抑制」と、「アルツハイマー型認知症における認知症症状の進行抑制(ただし,軽度及び中等度のアルツハイマー型認知症における認知症症状の進行抑制を除く。)」(実質的には、「高度アルツハイマー型認知症における認知症症状の進行抑制」)とが実質的に同一であるか否かであり、結論は否。被告の勝利。☆☆
■平成21(行ケ)10423等 審決取消請求事件 特許権 行政訴訟
平成23年02月22日 知的財産高等裁判所
判決
原 告 沢 井 製 薬 株 式 会 社
原 告 シ オ ノ ケ ミ カ ル 株 式 会 社
原 告 大 正 薬 品 工 業 株 式 会 社
原 告 大 洋 薬 品 工 業 株 式 会 社
原 告 東 和 薬 品 株 式 会 社
原 告 日 医 工 株 式 会 社
原 告 日 本 薬 品 工 業 株 式 会 社
原 告 株 式 会 社 陽 進 堂
原告ら訴訟代理人弁護士 伊 原 友 己 加 古 尊 温
弁理士 小 谷 悦 司 小 谷 昌 崇 戸 田 俊 材
被 告 エ ー ザ イ 株 式 会 社
訴 訟 代 理 人 弁 護 士 片 山 英 二 本 多 広 和
弁 理 士 小 林 浩 日 野 真 美 稲 葉 良 幸 内 藤 和 彦 山 田 拓
訴 訟 復 代 理 人 弁 護 士 根 本 浩
弁 理 士 上 野 さ や か
主 文
原告らの各事件請求を棄却する。
訴訟費用は原告らの負担とする。
事 実 及 び 理 由
第1 原告らが求めた判決
特 許庁が無効2008-800238号事件,無効2008-800239号事件,無効2008-800240号事件,無効2008-800241号事件,無 効2008-800242号事件,無効2008-800243号事件,無効2008-800244号事件の各事件につき,平成21年11月25日にした各 審決を取り消す。
(本件訴訟の事件番号が順に上記審判事件番号に対応する。)
第2 事案の概要
本件は,特許権の存続期間の延長登録に対する無効審判請求を不成立とする審決の取消訴訟である。争点は,本件延長登録に先だってされた延長登録の理由となった処分の対象物について特定された用途と,本件延長登録におけるそれとが実質的に同一であるか否か,である。
1 特許庁における手続の経緯及び薬事法上の承認
(1) 本件延長登録と無効審判請求
被告は,昭和63年6月22日,名称を「環状アミン誘導体」とする発明について特許出願(特願昭63-153852号)をし,平成8年11月7日に特許庁から特許第2578475号として設定登録を受けた(請求項の数6)。被告は,平成19年11月22日に本件特許の存続期間延長登録を出願し(2007-700111号,700112号,700113号,700114号,700115号,700116号,700117号),上記各出願につき延長の期間を5年とする本件特許権の存続期間の延長登録が平成20年6月25日にされたところ(本件延長登録),原告らは,平成20年11月7日,本件延長登録に対する無効審判請求をした。
特 許庁はこれらの請求を上記の出願番号順に,無効2008-800238号事件,800239号事件,800240号事件,800241号事 件,800242号事件,800243号事件,800244号事件として審理した上,平成21年11月25日,いずれの事件についても「本件審判の請求 は,成り立たない。」旨の審決をし,その謄本は平成21年12月7日原告らに送達された。
(2) 先の延長登録
本 件特許については,本件延長登録で理由となった承認処分の対象で特定された用途と実質的に同一の用途であると原告らが主張する「軽度及び中等度のアルツハ イマー型認知症における認知症症状の進行抑制」をもって,承認処分の対象となった物について特定された用途とし,その承認処分(先の承認処分)を理由とする存続期間延長登録が平成13年12月19日になされている(特願平11-700114号に基づく。2年11月12日の期間延長)。
(3) 本件延長登録の理由となった処分
本件延長登録は,本件特許に係る発明の実施について政令(特許法施行令)に定める処分を受けることが必要であったとして認められたものであり,その政令で定める処分の内容は,次のとおりである(本件承認処分)。
・ 標題 医薬品 製造販売承認事項一部変更承認
・ 承認番号
700111号の出願につき21100AMZ00662000号
700112号の出願につき21100AMZ00663000号
700113号の出願につき21900AMX01197000号
700114号の出願につき21600AMZ00405000号
700115号の出願につき21600AMZ00406000号
700116号の出願につき21900AMX01198000号
700117号の出願につき21300AMZ00373000号
・ 承認日 平成19年8月23日
・ 処分の対象となった物 塩酸ドネペジル
・ 処分の対象となった物について特定された用途
アルツハイマー型認知症における認知症症状の進行抑制(ただし,軽度及び中等度のアルツハイマー型認知症における認知症症状の進行抑制を除く。)
・ 販売商品名
700111号の出願につきアリセプト錠3㎎
700112号の出願につきアリセプト錠5㎎
700113号の出願につきアリセプト錠10㎎
700114号の出願につきアリセプトD錠3㎎
700115号の出願につきアリセプトD錠5㎎
700116号の出願につきアリセプトD錠10㎎
700117号の出願につきアリセプト細粒0.5%
2 本件特許発明の要旨(請求項1~6の記載)
【請求項1】
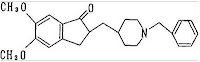
下記化学式で表される1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イル〕メチルピペリジン又はその薬理学的に許容できる塩。(化学式は省略)
【請求項2】
請求項1記載の1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イル〕メチルピペリジン又はその薬理学的に許容できる塩を有効成分とするアセチルコリンエステラーゼ阻害剤。
【請求項3】
請求項1記載の1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イル〕メチルピペリジン又はその薬理学的に許容できる塩を有効成分とする各種老人性痴呆症治療・予防剤。
【請求項4】
各種老人性痴呆症がアルツハイマー型老年痴呆である請求項3記載の治療・予防剤。
【請求項5】
1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イリデニル〕メチルピペリジンを還元し,必要により造塩反応を行うことを特徴とする請求項1記載の1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イル〕メチルピペリジン又はその薬理学的に許容できる塩の製造法。
【請求項6】
1-ベンジル-4-ピペリジンカルバルデヒドと5,6-ジメトキシ-1-インダノンを反応させて1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イリデニル〕メチルピペリジンとし,次いで還元し,必要により造塩反応を行うことを特徴とする請求項1記載の1-ベンジル-4-〔(5,6-ジメトキシ-1-インダノン)-2-イル〕メチルピペリジン又はその薬理学的に許容できる塩の製造法。
3 審決の理由の要点
請求人(原 告ら)は,本件延長登録が無効とされるべき理由として,先の存続期間延長登録の理由となった処分(先の承認処分)の対象となった物について特定された用途 は,「軽度及び中等度のアルツハイマー型認知症における認知症症状の進行抑制」(先の用途)であり,これを効能・効果とする処分に基づいて当該延長登
録は認められたとした上で,先の用途と,本件延長登録の理由となった処分(本件処分)の対象となった物について特定された用途(本件用途)である「アルツハマー型認知症における認知症症状の進行抑制(但し,軽度及び中等度のアルツハイマー型認知症における認知症症状の進行抑制を除く。)」(実質的には「高度のア
ルツハイマー型認知症における認知症症状の進行抑制」)は,実質的に同一であり,本件延長登録は,本件特許発明の実施に特許法67条2項の政令で定める処分を受けることが必要であったとは認められない場合の出願に対してされたものであると主張する。
しかし,先の用途である「軽度及び中程度のアルツハイマー型認知症における認知症症状の進行抑制」と本件延長登録に係る用途である「アルツハイマー型認知症における認知症症状の進行抑制(但し,軽度及び中程度のアルツハイマー型認知症における認知症症状の進行抑制を除く。)」(実質的には「高度アルツハイマー型認知症における認知症症状の進行抑制」)は実質的に同一ではないから,本件延長登録は,本件特許発明の実施について安全性の確保等を目的とする法律の規定による許可その他の処分であって政令で定めるものを受ける必要がない場合の出願に対してなされたものではない。
第3 原告ら主張の審決取消事由
特 許法67条2項の「その特許発明について・・・処分・・・を受けることが必要である」との文言は,薬事法所定の承認処分があったことをもって形式的に捉え るべきではなく,薬事法14条1項の承認の対象となる医薬品に関しては,物(有効成分)と用途(効能・効果)の2つの観点の異同につき処分を受けることが 必要であったか否かで判断されるべきであるところ,審決には,本件承認処分と先の承認処分の用途の同一性についての判断の誤りがあるので,違法として取り 消されるべきである。
1 「軽度及び中等度のアルツハイマー型認知症」と「高度のアルツハイマー型認知症」は,実質的には同一の疾患であること
(1) 各種診断基準において,アルツハイマー型認知症は・・・
2 「軽度及び中程度のアルツハイマー型認知症」と「高度アルツハイマー型認知症」の「症状」の相違をもって「病態」が異なるとの誤った判断に基づいて,本件医薬品の両者に対する効能・効果は実質的に異なるとの判断をした誤り
審決は,評価スケールの1つであるFASTの区分に示された「症状」がアルツハイマー型認知症の「病態」であるとして,「症状」の相違をもって「病態」が異なると判断し・・・。
3 医薬品の薬理作用の異同にかかわらず「軽度及び中等度のアルツハイマー型認知症」と「高度のアルツハイマー型認知症」に対する効能・効果は異なるとの判断をした誤り
審 決は,「軽度及び中等度のアルツハイマー型認知症」と「高度のアルツハイマー型認知症」が実質的に異なる疾患であるとの誤った判断に加えて,「医薬品の薬 理作用の異同にかかわらず,『高度のアルツハイマー型認知症における認知症症状の進行抑制』は,『軽度及び中等度のアルツハイマー型認知症における認知症 症状
の進行抑制』と異なる効能・効果である。」と判断した・・・
4 薬事法所定の承認処分をもって特許法上の用途(効能・効果)も異なるとの判断をした誤り
審 決は,「上記(5-2)において認定したとおり,塩酸ドネペジルを有効成分とするアルツハイマー型認知症症状の進行抑制剤について,我が国においてはその 適用対象の患者の病態が『軽度及び中等度』に対してのみ承認されていたが,日本人の『高度』のアルツハイマー型認知症患者を対象とした国内臨床試験の結果 に基づき,塩酸ドネペジルが『高度』の認知症症状の進行抑制に対する有効性を示すことが認められ,さらに,国内臨床現場に『高度』のアルツハイマー型認知 症の進行抑制に使用できる薬剤を初めて提供する意義が考慮され,効能・効果に『高度のアルツハイマー型認知症』における認知症症状の進行抑制を追加する本 件処分がなされたのであるから・・・
5 審決が維持された場合に生じる弊害等
ア ルツハイマー型認知症は同一の病理学的変化が連続して進行していくという進行性,連続性の疾患であって,その進行に伴って諸般の症状が進行するにすぎず, 同一患者における進行度の違いを病期で表現しているにすぎないところ,病期を統一的,画一的に区別できる客観的な方法はなく,先の承認処分及び本件承認処 分における「中等度」と「高度」の区別についても統一的,画一的な客観的手法はない。高度アルツハイマー型認知症に関し本件特許権の存続期間延長が認めら れると,軽度及び中等度アルツハイマー型認知症に対してはいわゆる後発薬を使用できるが,高度アルツハイマー型認知症に対しては後発薬は使用できないこと になるが,上記のとおり,「中等度」と「高度」の区別について統一的,画一的な客観的手法がないことに照らすと,かかる事態は医療現場に混乱が生じさせる ものである。また・・・。
第4 被告の反論
審決の認定判断に誤りはなく,原告ら主張の取消事由は理由がない。
1 用途の同一性は効能・効果の同一性により判断されること
特 許法は,同法67条2項の政令で定める処分の対象となった「物」及び「用途」ごとに特許権の存続期間の延長登録の出願をすべきであるという制度を採用して おり,処分の対象となった「物」は「有効成分」を,「用途」は「効能・効果」を意味するものと解される(知財高裁平成19年7月19日判決〔平成18年 (行ケ)第10311号〕,乙4)。
2 厚生労働省が新効能医薬品として承認していること
医 薬品の製造販売の承認については,薬事法第14条の規定に基づき,これを製造販売しようとする者から申請があった場合に,申請に係る医薬品の成分・分量, 用法・用量,効能・効果,副作用等に関する所要の審査を行った上で,厚生労働大臣が品目ごとにその承認を与えることとされており,承認申請にあたっては, その時点における医学薬学等の学問水準に基づき,倫理性,科学性及び信頼性の確保された資料により,申請に係る医薬品の品質,有効性及び安全性を立証する ための十分な根拠が示される必要がある(薬食発第0331015号「医薬品の承認申請について」,甲11の1頁)。そして,医薬品医療機器総合機構(当 局)は,申請に係る医薬品の成分・分量,用法・用量,効能・効果,副作用等に関する所要の審査に必要な情報を精査して,申請に係る医薬品の申請区分(甲 11別表2-(1)),承認申請書に記載される「効能・効果」の記載について審査し,その妥当性について判断する。ここで,申請に係る医薬品は,上記別表 に記載のように,例えば(1)新有効成分含有医薬品,(2)新医療用配合剤,(3)新投与経路医薬品,(4)新効能医薬品,(5)新剤型医薬品,(6)新用量医薬品,(7)剤型追加に係る医薬品などに分類されるところ,本件処分に係る医薬品は「(4)新効能医薬品」として審査され,承認されたも のである。上記通知(甲11)によれば,「(4)新効能医薬品」は,「既承認医薬品等と有効成分及び投与経路は同一であるが,効能・効果が異なる医薬品を いう」と定義されている。「新効能医薬品」については,当局の専門の審査官が,上記承認申請書に添付すべき資料(申請資料)を精査した結果,既承認医薬品 と効能・効果が異なるものであるか否か調査し,その新効能についての有効性を審査し,その新効能について有効性が認められると判断して初めて効能追加の一 部変更承認を得られるのである。このように,本件承認処分においては,当局の専門の審査官が,本件医薬品は既承認医薬品である軽度及び中等度アルツハイ マー型認知症における認知症症状の進行抑制と効能・効果が異なる「新効能医薬品」として妥当であると判断し,有効性・安全性に関する審査を行っているので あるから,このような医薬品の審査における専門性を備えた担当官の判断を覆して,本件承認処分の追加効能・効果が先の承認処分の効能・効果と異なるもので はないと判断することには無理がある。存続期間延長登録出願の審査に際して,医薬品の製造販売承認を担当する当局の専門の審査官の判断は尊重されるべきで ある。
審 決は,本件承認申請に対する審査の経緯を認定した上,これに基づき,「効能・効果に『高度のアルツハイマー型認知症』における認知症症状の進行抑制を追加 する本件処分がなされた」のであるから,本件処分において,「軽度及び中等度アルツハイマー型認知症における認知症症状の進行抑制」と「高度アルツハイ マー型認知症における認知症症状の進行抑制」は,実質的に異なる効能・効果であるとして認識されていたことは明らかである旨判断している(13頁5~10 行)。審決は,当局の審査において「軽度及び中等度アルツハイマー型認知症における認知症症状の進行抑制」と「高度アルツハイマー型認知症における認知症 症状の進行抑制」が効能・効果が異なるものとして扱われ,本件医薬品の効能・効果にその「高度アルツハイマー型認知症における認知症症状の進行抑制」とい う新たな効能・効果を追加することが承認されたことをもって,軽度及び中等度アルツハイマー型認知症における認知症症状の進行抑制と高度アルツハイマー型 認知症における認知症症状の進行抑制が実質的に異なる効能・効果であると判断しているのであり,その点に何ら誤りはない。
また,製造販売承認により医薬品の販売は法的には可能となるものの,その医薬品について薬価が決定され,「使用薬剤の購入価格(薬価基準)」に収載されなければ,保険給付の対象とならず,事実上,当該医薬品を患者に施用したり処方したりすることはできない(健康保険法第63条,第64条,保険医療機関及び保険医療養担当規則第19条,平成18年厚生労働省告示第107号)。薬価収載された際に記載される「効能・効果」は,製造販売承認時の「効能・効果」そのものであるところ,塩 酸ドネペジルの最初の承認の際には,保険発第156号「薬価基準の一部改正について」(甲18)の「Ⅱ2アリセプト錠3mg,同5mgの保険適用上の取扱 い等」の欄に「(1)効能又は効果『軽度及び中等度のアルツハイマー型痴呆における痴呆症状の進行抑制』であることから,軽度又は中等度のアルツハイマー 型痴呆であることが確認された患者に対して使用した場合に限り算定できるものであること。」と記載された。上記留意事項は,先の承認処分に係る医 薬品は高度アルツハイマー型認知症患者には保険適用できないこと,すなわち,薬事法上,軽度及び中等度アルツハイマー型認知症と高度アルツハイマー型認知 症とは別の疾患として取り扱われていることの証左である。審決も,上記の留意事項として「軽度及び中等度アルツハイマー型認知症患者」に適用した際のみ保 険適用がされると記載されていることを,軽度及び中等度アルツハイマー型認知症における認知症症状の進行抑制と高度アルツハイマー型認知症における認知症 症状の進行抑制が効能効果を異にすることの根拠としており,その点に何ら誤りはない。
・・・。
第4 当裁判所の判断
1 アルツハイマー型認知症について
(1) アルツハイマー型認知症の定義,罹患の原因,病態(病態生理),症状等に関し,下記のア~オの文献に記載されているのは次のとおりである。
・・・。
2 先の承認処分と本件承認処分における軽度及び中等度アルツハイマー型認知症並びに高度アルツハイマー型認知症の違いについて
審 決は,病態が異なることを根拠にして,「軽度及び中等度のアルツハイマー型認知症」と「高度アルツハイマー型認知症」は病態に基づいて区別し得る実質的に 異なる疾患であるとし(各審決書13頁~14頁),被告も同趣旨の主張をする。しかし,前記のとおり,各種医学書籍はアルツハイマー病ないしアルツハイ マー型認知症を1つの疾患として扱い,それを初期・中期・後期,あるいは軽度・中等度・高度といった段階に分けていることが認められる。
ま た,本件承認処分に係る医薬品製造販売承認事項一部変更承認申請書(甲2の4)に変更の内容及び理由として「本申請は,高度アルツハイマー型認知症患者を 対象とした臨床試験の結果より,『効能又は効果』について,重症度に関係なく軽度から高度に至るアルツハイマー型認知症全般の認知症症状の進行抑制に使用 できることとします。また,それに伴い『用法及び用量』を高度アルツハイマー型認知症患者では1日10㎎に増量するように変更する一部変更承認申請で す。」と記載されており,本件承認処分に係る承認申請(本件承認申請)に関する審査報告書(甲3)に「本薬は,日本人高度アルツハイマー型認知症患者を対 象とした国内231試験において,SIB及びCIBIC p1usの 二つの主要評価項目で,ともに有効性を示したことから,既承認の軽度及び中等度と併せて,重症度に依らず認知症症状の進行を抑制する薬剤と位置付けられる とした機構の判断は,専門協議において支持された。」(33頁)と記載されていることに照らすと,被告及び審査当局(独立行政法人医薬品医療機器総合機 構)はアルツハイマー型認知症をその重症度に応じて軽度,中等度及び高度に分けていることが認められる。
そうすると,先の承認処分及び本件承認処分における「軽度及び中等度のアルツハイマー型認知症」と「高度アルツハイマー型認知症」は実質的に異なる疾患というよりも,アルツハイマー型認知症という1つの疾患を重症度によって区分したものであると認めるのが相当である。
そして,本件承認申請に係る審査報告書(甲3)の10頁,16頁によれば,本件承認処分のための国内臨床試験及び外国臨床試験における被験者の選択基準として,観察開始日(投与4週前)のFASTが6以上の者,観察開始日(投与4週前)のMini-Mental State Examination(MMSE:簡易認知機能検査)が1ないし12点であるといった条件を満たす50歳以上の患者とされていることに照らすと,本件承認処分における高度アルツハイマー型認知症はFASTが6以上という条件を満たすアルツハイマー型認知症を前提としていると解される。よ り具体的には,前記FASTの分類基準によれば,軽度アルツハイマー型認知症の場合,更衣,排泄,食事といった日常生活の基本的な立ち振舞いは問題がない ものの,中等度のアルツハイマー型認知症では基本的な立ち振舞いに問題がみられるようになり,やや高度・高度のアルツハイマー型認知症では,日常生活の基 本的な立ち振舞いの多くに障害が認められ,日常生活を他人の介助なしには行うことができない状態になると認められ,かかる点において軽度及び中等度アルツ ハイマー型認知症と高度アルツハイマー型認知症に差異があることを前提としていると認められる。
3 先の承認処分と本件承認処分における本件医薬品の薬理作用について
(1) 下記甲3,6の報告書及び文献には,以下の記載がある。
・・・。
4 本件承認処分に至る経緯
(1) 前記審査報告書(甲3)には,以下の記載がある。
・・・。
国における使用状況等に関する使用」の欄
塩酸ドネペジル(以下,本薬)は,エーザイ株式会社で開発されたアセチルコリンエステAChE ラーゼ(以下,AChE )阻害剤であり,本邦では,「軽度及び中等度のアルツハイマー型痴呆における痴呆症状の進行抑制」を効能・効果として,平成11年10月8日に「アリセプト錠3mg」及び「アリセプト錠5mg 」が、平成13年 3月 1日に「アリセプト細粒0.5%」が、平成16年2月26日に「アリセプトD錠3mg」及び「アリセプトD錠5mg」が承認されている。今般,高度アルツハイマー型認知症患者を対象とした臨床試験成績等に基づき,対象患者に高度アルツハイマー型認知症患者も加えた「アルツハイマー型痴呆における痴呆症
状の進行抑制」を効能・効果として,高用量投与のため「アリセプト錠10mg」及び「アリセプトD錠10mg」の剤型を追加する承認がなされた。なお,現時点で本邦において,高度のアルツハイマー型認知症の効能・効果を有する薬剤は承認されていない。
・・・。
(2) 上記審査報告書の記載によれば,日本では,本件承認処分前において,
①塩酸ドネペジルは軽度及び中程度のアルツハイマー型認知症における認知症症状の進行抑制を効能・効果として承認されていたが,高度のアルツハイマー型認知症における認知症症状の進行抑制を効能・効果とする承認は塩酸ドネペジルに対してだけでなくいかなる薬剤に対しても一切なされていなかったところ,②塩酸ドネペジルの高度アルツハイマー型認知症患者を対象とした臨床試験成績等に基づき,塩酸ドネペジルについて,対象患者に高度アルツハイマー型認知症患者も加えた「アルツハイマー型痴呆における痴呆症状の進行抑制」を効能・効果とする本件承認申請がなされ,③この申請が独立行政法人医薬品医療機器総合機構において審査され,高度のアルツハイマー型認知症では,これまでの2倍量が投与されることに対して安全性上の懸念が示されたが,投与初期に3mg/日及び5mg/日 を経て適切に増量することにより大きな問題はなく,国内臨床現場に高度アルツハイマー型認知症の進行抑制に使用できる薬剤を初めて提供する意義はあり,本 件承認申請は承認可能とされたところ,④日本人高度アルツハイマー型認知症患者を対象とした国内臨床試験において有効性を示したことから,塩酸ドネペジル を重症度に依らず認知症症状の進行を抑制する薬剤と位置づけることが,専門協議において支持され,⑤独立行政法人医薬品医療機器総合機構は,本件承認申請 を承認して差し支えないとの最終的な判断をしたことが認められる。
5 先の承認処分における用途と本件承認処分における用途の同一性について
前 記認定によれば,軽度及び中等度アルツハイマー型認知症と高度アルツハイマー型認知症との差異は,緩やかにかつ不可逆的に進行するアルツハイマー型認知症 の重症度による差異であると解されるところ,塩酸ドネペジルが軽度及び中等度アルツハイマー型認知症症状の進行抑制に有効かつ安全であることが確認されて いたとしても,より重症である高度アルツハイマー型認知症症状の進行抑制に有効かつ安全であるとするには,高度アルツハイマー型認知症の患者を対象に塩酸 ドネペジルを投与し,その有効性及び安全性を確認するための臨床試験が必要であったと認められる。
そして,・・・
6 原告らの主張する弊害について
先 の承認処分と本件承認処分における「軽度及び中等度アルツハイマー型認知症」と「高度アルツハイマー型認知症」の区別については,前記の本件承認処分に至 る経緯に鑑みると,FASTが6以上のアルツハイマー型認知症を「高度アルツハイマー型認知症」とすることを前提としていると解される。しかし・・・。
しかし,この主張自体仮定的なものであるし,また・・・
第5 結論
以上によれば,原告ら主張の取消事由は理由がない。
よって原告らの請求を棄却することとして,主文のとおり判決する。
知的財産高等裁判所第2部
裁判長裁判官 塩 月 秀 平
裁判官 真 辺 朋 子
裁判官 田 邉 実
■参考
・特許2578475情報
発明の名称:環状アミン誘導体
出願番号:特願昭63-153852
出願日:昭和63年(1988)6月22日
公開日:平成1年(1989)3月24日
登録日:平成8年(1996)11月7日
存続期間満了日:平25.6.22
・特願昭63-153852の分割:特許2733203
出願番号:特願平6-291169
公開日:平成7年(1995)10月3日
登録日:平成9年(1997)12月26日
本権利消滅日:平20.6.22
・特願平6-291169の分割:特許3078244
出願番号:特願平9-186306
公開日:平成10年3月10日(1998.3.10)
登録日:平成12年6月16日(2000.6.16)
本権利消滅日:平20.6.22
請求項1:次の一般式(I-1) で表される環状アミン誘導体又はその薬理学的に許容できる塩。
・アリセプト情報
1. 開発の経緯
ドネペジル塩酸塩はアセチルコリンエステラーゼ阻害剤であり、[1]血漿中濃度消失半減期が長いこと、[2]末しょう性の副作用が少ないこと、[3]生体利用率が高く脳移行性も良いこと、の3項目を満たす化合物としてエーザイ株式会社によって探索研究された結果、見出された。国内では1989年1月より、米国では1991年2月より臨床試験を開始し、米国で1996年3月に申請し、優先審査により1996年11月に承認された。次いで米国の臨床試験データを基本として英国で1996年10月に申請、1997年2月に承認された。日本では1998年7月に申請し、優先審査により1999年10月承認された。軽度及び中等度アルツハイマー型痴呆(認知症)の適応に関して、2007年5月現在、アメリカ、イギリス等90カ国以上で承認されている。
日本における適応症は、1999年承認時点では、「軽度及び中等度アルツハイマー型痴呆(認知症)における痴呆(認知症)症状の進行抑制」であった。その後、「高度アルツハイマー型認知症」に関する臨床試験を実施し、錠、細粒、D錠について2005年12月に製造販売承認申請を行い、2007年8月に重症度に関係なく軽度から高度に至る「アルツハイマー型認知症における認知症症状の進行抑制」に対する適応が承認された。なお、2007年5月現在、アメリカ、インド等の数カ国において「高度アルツハイマー型認知症」に関する適応の承認を取得している。
日本において発売されている剤形については、錠剤(3mg、5mg含有)として1999年に承認されたが、対象患者は高齢者が多く、服用性の改善が要望されたことから、服用しやすい細粒剤(0.5%含有)を開発し、2001年3月承認された。その後、服薬困難を伴う患者に対して更に服用しやすい剤形が期待され、口腔内崩壊錠(以下D錠、3mg、5mg含有)の開発を2001年3月より開始し、2003年2月申請、2004年2月に承認された。また2007年8月にアルツハイマー型認知症全般に対する適応が承認されるのと同時に10mg含有製剤(錠10mg、D錠10mg)が承認された。
また、認知症患者では症状の進行により嚥下障害等が増加するため、服薬コンプライアンスが低下する傾向にある。その解消を目的として、水分誤嚥のある嚥下困難者等を対象にアリセプト内服ゼリーが開発され、2008年3月に申請、2009年7月に承認された。
日本における適応症は、1999年承認時点では、「軽度及び中等度アルツハイマー型痴呆(認知症)における痴呆(認知症)症状の進行抑制」であった。その後、「高度アルツハイマー型認知症」に関する臨床試験を実施し、錠、細粒、D錠について2005年12月に製造販売承認申請を行い、2007年8月に重症度に関係なく軽度から高度に至る「アルツハイマー型認知症における認知症症状の進行抑制」に対する適応が承認された。なお、2007年5月現在、アメリカ、インド等の数カ国において「高度アルツハイマー型認知症」に関する適応の承認を取得している。
日本において発売されている剤形については、錠剤(3mg、5mg含有)として1999年に承認されたが、対象患者は高齢者が多く、服用性の改善が要望されたことから、服用しやすい細粒剤(0.5%含有)を開発し、2001年3月承認された。その後、服薬困難を伴う患者に対して更に服用しやすい剤形が期待され、口腔内崩壊錠(以下D錠、3mg、5mg含有)の開発を2001年3月より開始し、2003年2月申請、2004年2月に承認された。また2007年8月にアルツハイマー型認知症全般に対する適応が承認されるのと同時に10mg含有製剤(錠10mg、D錠10mg)が承認された。
また、認知症患者では症状の進行により嚥下障害等が増加するため、服薬コンプライアンスが低下する傾向にある。その解消を目的として、水分誤嚥のある嚥下困難者等を対象にアリセプト内服ゼリーが開発され、2008年3月に申請、2009年7月に承認された。
※インタビューフォームより抜粋(下線除く)
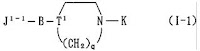

コメント