・令和5年9月28日判決言渡
・東京地方裁判所民事第47部 杉浦正樹 小口五大 久野雄平
・原告:アムジエン・インコーポレーテツド
・被告:サノフィ株式会社
・特許5705288
・発明の名称:プロタンパク質コンベルターゼスブチリシンケクシン9型(PCSK9)に対する抗原結合タンパク質
抗PCSK9抗体に関する特許5705288の侵害訴訟のご紹介です。
特許5705288に関しては、これまでにも無効審判や侵害訴訟があり、特許権者のアムジェン(原告)の有利に進んだ後、サノフィ(被告)に有利な結果がでていました。
経緯について簡単に説明しますと、
抗PCSK9抗体を有効成分とする抗体医薬として、アムジェンはレパーサ(エボロクマブ)を販売しています。効能・効果は、家族性高コレステロール血症又は高コレステロール血症(但し、心血管イベントの発現リスクが高く、HMG-CoA還元酵素阻害剤で効果不十分又は適さない場合)です。
一方で、抗PCSK9抗体を有効成分とする抗体医薬として、サノフィがプラルエント(アリロクマブ)を販売していました(別件の侵害訴訟の結果、2020年に日本での販売を停止しています)。本件の原告のリジェネロンは、アリロクマブを創製した企業であり、サノフィと共同開発していました。
2014年10月にアムジェンは、米国において、プラルエントがアムジェンのレパーサ米国特許(US8829165及びUS8859741)を侵害しているとして、デラウエア州地方裁判所に侵害訴訟を提起しました。
その後、2015年3月にレパーサ米国特許のファミリー出願である特許5705288が日本で特許登録され、サノフィが日本で無効審判を請求しました。さらに、2017年、2020年にアムジェンは日本で侵害訴訟(差止め、損害賠償請求)を提訴しました。
日本の審判、訴訟の経緯はおよそ以下の通りです。
●2015/03/06:特許登録
●2016/01/18:1回目無効審判(請求人:サノフィ)
●2017/08/02:1回目審決(請求不成立)
●2018/12/27:判決・審決取消訴訟・知財高裁(請求棄却)
●2019/01/17:判決・1回目侵害訴訟・東京地裁(差止め)
●2019/10/30:判決・1回目侵害訴訟・知財高裁(控訴棄却) ←①
●2020/02/12:2回目無効審判(請求人:リジェネロン)
●2020/04/24:上告不受理(審決取消訴訟、侵害訴訟)
●2020/05/07:サノフィがプラルエントの日本での販売停止を発表
●2021/04/07:2回目審決(請求不成立) ←②
●2023/01/26:判決・審決取消訴訟(審決取消) ←③
●2023/09/28:判決・2回目侵害訴訟(損害賠償)・東京地裁(非侵害) ←いまココ
このうち、①、②、③は下記ブログで紹介しています。



本件特許の請求項1、9は以下の通りです。
PCSK9とLDLRタンパク質の結合を中和することができ、PCSK9との結合に関して、配列番号49のアミノ酸配列からなる重鎖可変領域を含む重鎖と、配列番号23のアミノ酸配列からなる軽鎖可変領域を含む軽鎖とを含む抗体と競合する、単離されたモノクローナル抗体。
【請求項9】
請求項1に記載の単離されたモノクローナル抗体を含む、医薬組成物。
(以下、請求項 9 に係る発明(ただし、請求項 1 に係るもの)を「本件発明 1」 という。また、「配列番号 49 のアミノ酸配列からなる重鎖可変領域を含む重鎖と、配列番号 23 のアミノ酸配列からなる軽鎖可変領域を含む軽鎖とを含む抗体」を「21B12 抗体」という。)
今回、東京地裁は、本件発明はサポート要件及び実施可能要件を満たさないと判断し、原告の請求を棄却ました。
東京地裁の判断をまとめると、およそ下記(1)~(4)のようになります。
(1)EGFaミミック抗体(※アリロクマブが含まれる)とは、15個のPCSK9のコア残基の大部分を認識する結合中和抗体である。
↓
(2)EGFaミミック抗体は本件発明に含まれる。
↓
(3)EGFaミミック抗体は、本件明細書及び出願当時の技術常識に基づいて作製できない。
↓
(4)従って、サポート要件及び実施可能要件を満たさない。
この判断は、同じくサポート要件を認めなかった知財高裁の「令和3年(行ケ)第10093号 審決取消請求事件」とは少し異なります。
何が違うかというと、今回の東京地裁は「一点突破型」の論理構成なのかなと思います。即ち、EGFaミミック抗体に論点を絞っています。
判決では、EGFaミミック抗体の取得困難性に関して以下のようにコメントされています。
これらの事情を踏まえると、本件明細書に記載された抗体の作製方法に関する記載をもって、本件明細書の発明の詳細な説明が、本件発明に含まれるEGFaミミック抗体を当業者が作製できるように記載されているということも、また、本件発明に含まれるEGFaミミック抗体が本件明細書の発明の詳細な説明に記載されているということもできない。
そもそも、原告は、本件特許の出願日から約4年後の2012年(平成24年)に至っても、EGFaミミック抗体を取得できていないことを自認している上、EGFaミミック抗体を見つけることは一筋縄ではいかないだろうと述べている(前記(5)ア)。
このように、EGFaミミック抗体は、特許権者が本件出願日の後にあっても取得できておらず、取得困難と認識している抗体である。
以上によれば、本件明細書にはEGFaミミック抗体及びその具体的な作製方法は記載されておらず、当業者において、本件明細書の記載及び本件特許出願当時の技術常識によっては、これを作製できないものと認められる。
したがって、本件発明は、いずれも発明の詳細な説明に記載されたものとはいえず、また、発明の詳細な説明が、その発明の属する技術の分野における通常の知識を有する者がその実施をすることができる程度に明確かつ十分に記載されたものともいえない。すなわち、本件特許は、サポート要件及び実施可能要件に違反し、特許無効審判により無効にされるべきものである。
ところで、「一点突破型」の論理構成がOKだとすると、本件のように下記の(a)~(c)の条件を全て満たす場合、イ号製品が特許発明の技術的範囲に含まれていても、無効理由ありで非侵害になるという状況が生まれやすくなる気もします。
(a)イ号製品が、対象特許の実施例製品よりも優れた効果を有する。
(b)イ号製品の特徴xが、対象特許クレームの特徴Xの下位概念である。
(c)特徴xを選択することに運が関与する。
運が関与することはあるのか、ということに関しては。機能限定を有するバイオ医薬特許や、置換基をRで定義した低分子化合物の特許などでは、普通にありえるように思います。
また、イ号製品と関係なくても、運が関与する部分があることに基づいて、一応の無効理由の論理構成を作ることもできそうです。
そうすると、なかなか尖った判決だなと思えてきます。
本件は、上記の発明者の電子メールを手に入れることに成功したレアケースともいえるので、しょうがないのでしょうか。
今後、知財高裁がこれをどのように判断するのか、要チェックですね。
過去の一般的な判決で「一点突破型」がどのように判断されているのか調べてみても面白そうです。
裁判所の判断の抜粋を以下に記載します。
1 事案に鑑み、まず、サポート要件違反(争点 2-1)及び実施可能要件違反(争点 2-2)の被告主張に係る理由 2 について検討する。
・・・
(2) 本件発明の概要
本件明細書の上記開示事項によれば、本件発明は、LDLRタンパク質の量を増加させることにより、対象中のLDLの量を低下させ、対象中の血清コレステロールの低下をもたらす効果を奏し、また、この効果により、高コレステロール血症等の上昇したコレステロールレベルが関連する疾患を治療し、又は予防し、疾患のリスクを低減すること、そのために、LDLRタンパク質と結合することにより、対象中のLDLRタンパク質の量を減少させ、LDLの量を増加させるPCSK9とLDLRタンパク質との結合を中和する抗体又はこれを含む医薬組成物を提供することを課題とした上で、PCSK9はLDLRのEGFaドメインに結合すること、及び、参照抗体は、結晶構造上、LDLRのEGFaドメインの位置と部分的に重複する位置でPCSK9とLDLRタンパク質の結合を立体的に妨害し、その結合を強く遮断する中和抗体であり、参照抗体と「競合」するモノクローナル抗体は、PCSK9への参照抗体の結合を妨げ、又は阻害する(例えば、低下させる)抗体であることを明らかにするものである。
・・・
(5) 「EGFa ミミック抗体」について
ア 証拠(甲 2、4、乙 4、50)及び弁論の全趣旨によれば、以下の事実が認められる。
本件発明の発明者の1人は、本件特許の優先日から約5年後、出願日から約4年後の2012年(平成24年)の電子メール(以下「本件メール」という。)に、「我々は、現在、EGFaミミック抗体を取得できていない、しかし、ファイザーは有しているから、それは可能なはずである〔(RN316)〕…EGFa ミミック抗体は、我々が現在有する抗体の 2 つの一部重複するエピトープのちょうど中間に位置することから、EGFaミミック抗体を見つけることは一筋縄ではいかないだろう。」と記載していた。また、原告が2012年(平成24 年)に作成した資料には、次の「Conceptual Epitope Space(概念的なエピトープスペース)」と題する図(以下「本件プレゼンテーション資料」という。)が含まれている。これには、21B12抗体及び31H4抗体を示す各楕円形の中間に’Missing Epitope…’(見つからないエピトープ)との記載がある。
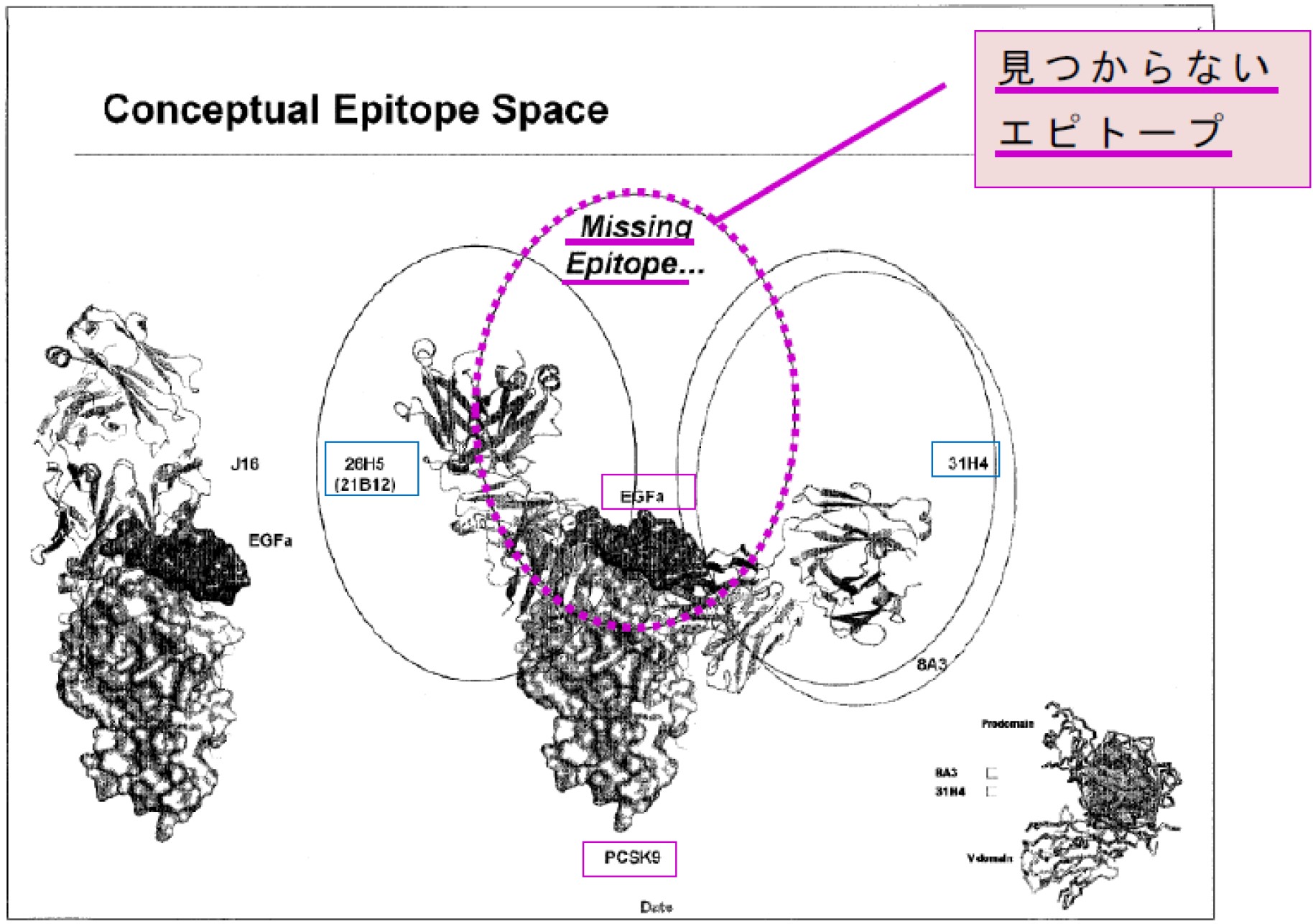
前記((1)ウ)のとおり、15個のPCSK9のコア残基、すなわちLDLRのEGFaドメインとの相互作用界面の特異的コアPCSK9アミノ酸残基(S153、I154、P155、R194、D238、A239、I369、S372、D374、C375、T377、C378、F379、V380及びS381)と相互作用し、又は遮断する抗体は、PCSK9/LDLR相互作用の阻害のために有用であり得る。本件明細書の各実施例抗体と、それらが認識し、結合するPCSK9のコア残基との対応関係は、結合部位対照表のとおりである。なお、同表中に「アムジェンの抗体」と示される抗体が本件明細書記載の各実施例抗体である。また、同表の「J16」は、ファイザー社の抗体であり、本件メールに「RN316」、本件プレゼンテーション資料に「J16」と記載されているものと同一の抗体である(以下「J16抗体」という。)。
イ 「EGFaミミック抗体」の意味
上記アのとおり、「EGFaミミック抗体」なる語は、本件発明の発明者自身が使用したものである。そこで、その意味について検討する。
(ア) 「EGFaミミック抗体」との用語は、「ミミック(mimic)」の語義(「模倣する」、「擬態する」等)に照らせば、「模倣」ないし「擬態」といい得る程度に、LDLRのEGFaドメインが結合する部位であるPCSK9の表面上のアミノ酸を多く認識する抗体を意味するものと理解できる。
(イ) 本件発明の発明者は、本件メールにおいて、EGFaミミック抗体は、原告が有する2つの抗体(21B12抗体及び31H4抗体)の一部重複するエピトープのちょうど中間に位置するとしている。原告が作成した本件プレゼンテーション資料においても、PCSK9に結合する21B12抗体と31H4抗体の間の、「EGFa」と記載されたPCSK9上のスペースが「見つからないエピトープ」とされ、当該部分にJ16抗体が結合した図が示されている。また、「エピトープ」につき、本件明細書には、「エピトープは、その抗原を標的とする抗原結合タンパク質によって結合される抗原の領域であり、抗原がタンパク質である場合、抗原結合タンパク質に直接接触する特定のアミノ酸を含む。」との記載がある(【0142】)。これらの事情を踏まえると、原告は、「EGFaミミック抗体」につき、「見つからないエピトープ」とされている特定の結合部位に結合する抗体を示す意味で用いていたものと理解される。
加えて、本件メール及び本件プレゼンテーション資料によれば、原告は、J16抗体をEGFaミミック抗体と認識していたとみられるところ、結合部位対照表によれば、同抗体は、15個のPCSK9のコア残基のうち14個を認識する抗体である。
そうすると、本件発明の発明者を始めとする原告側において、「EGFaミミック抗体」の語は、15個のPCSK9のコア残基の大部分を認識する、すなわち、LDLRのEGFaドメインが結合する部位であるPCSK9表面上の各アミノ酸を覆うように直接的に結合する抗体を意味するものとして使用されていたことがうかがわれる。
(ウ) これらの事情を総合的に考慮すると、「EGFaミミック抗体」とは、15個のPCSK9のコア残基の大部分を認識する結合中和抗体を意味するものと理解される。
(エ) これに対し、原告は、EGFaミミック抗体は21B12抗体と31H4抗体の両方と競合する抗体を指すとか、9C9抗体がEGFaミミック抗体であるかのような主張をする。
しかし、原告は、本件メールにおいて「EGFaミミック抗体」をいかなる文脈において用いていたのか明らかにしない。その点を措くとしても、21B12抗体と31H4抗体の両方と競合する抗体も9C9抗体も本件明細書に記載されているところ(【0138】、実施例37、【表17】、【0494】)、これらがEGFaミミック抗体であるとすれば、本件発明の発明者が、本件特許の出願日から約4年後に、本件メールにおいて、EGFaミミック抗体を取得できていないとしていることとおよそ整合しない。
なお、原告は、甲55文献では「ミミック」は抗体自体の立体構造に対して向けられており、これがLDLRのEGFaドメインと似ているかどうかという観点で記述されているから、「ミミック」という用語がPCSK9上で抗体がいくつのアミノ酸を認識するかという意味で用いられてはいないと主張する。
甲55文献は、2010年(平成22年)に公表された文献であり、結合部位対照表にも記載のある1D05抗体について記載されている。
同文献には、「我々は、PCSK9にナノモルの親和性で結合するフラグメント抗原結合型(Fab)1D05を同定した。この完全ヒト型抗体1D05-IgG2は、野生型PCSK9及び2つの機能獲得型ヒトPCSK9変異体(S127R及びD374Y)の阻害作用を完全に遮断する。PCSK9に結合した1D05-Fabの結晶構造から、1D05-FabはLDLrEGF(A)結合部位全体を含むPCSK9触媒ドメインのエピトープに結合することが明らかとなった。また、1D05-FabのCDR-H3及びCDR-H2ループは、LDLrのEGF(A)ドメインを構造的にミミックしていることが注目される。」、「PCSK9/1D05とPCSK9/EGF(A)の構造(12,27)の重ね合わせから、1D05のCDR-H3はヘアピン構造をとり、構造的にEGF(A)の2つのβ鎖…をミミックしている。」、「残基Gly50-Gly56からなるCDR-H2ループの先端は、構造的にEGF(A)のヘリカルターン(残基Gly293-Asp299)をミミックしている。」との記載がある。これらの記載は、「ミミック」の語につき、抗体の立体構造に着目して使用しているものとも理解し得る。
しかし、他方で、「PCSK9ΔC/1D05複合体において無秩序であるSer153及びIle154を除いて、EGF(A)と接触するPCSK9のすべてのアミノ酸も1D05と相互作用する。以上のように、構造的分析は、1D05がPCSK9との相互作用においてLDLrのEGF(A)ドメインを構造的にミミックし、その結果、PCSK9が受容体に結合するのを立体的に防止することによりPCSK9を阻害することを明らかにした。」と、PCSK9のコア残基に着目しているかのような、1D05抗体が15個のPCSK9のコア残基のうち13個を認識する(相互作用する)旨の記載もある。また、上記(イ)のとおり、原告は、EGFaミミック抗体の語を、構造的類似性ではなく特定の結合部位に結合する抗体を示す観点で使用していたものである。
したがって、この点に関する原告の主張は採用できない。
(6) EGFaミミック抗体が本件発明に含まれること
EGFaミミック抗体とは、15個のPCSK9のコア残基の大部分を認識する結合中和抗体である(前記(5)イ(ウ))。また、本件発明における「中和」とは、PCSK9のLDLRタンパク質結合部位を直接封鎖することによって、PCSK9とLDLRタンパク質の間の相互作用を妨害し、遮断し、低下させ、又は調節することを含む意味である(前記(3))。さらに、参照抗体との「競合」とは、参照抗体がPCSK9と結合する部位と同一又は重複するPCSK9上の部位に結合して、参照抗体の特異的結合を妨げ、又は阻害する(例えば、低下させる)ことを含む意味である(前記(4))。
結合部位対照表によれば、15個のPCSK9のコア残基の大部分を認識するEGFaミミック抗体は、参照抗体である21B12抗体及び31H4抗体のいずれに対する関係でも、同各抗体が結合するPCSK9のコア残基と同一又は重複する部位に結合し、参照抗体の特異的結合を妨げ、又は阻害すると共に、LDLRタンパク質結合部位を直接封鎖して、PCSK9とLDLRタンパク質の間の相互作用を妨害等するものといえる。
したがって、EGFa ミミック抗体は本件発明に含まれる。
(7) サポート要件違反及び実施可能要件違反の有無
ア 本件明細書には、本件発明に関し、前記各認定の記載に加え、次の事項が記載されている。
・・・
イ 本件発明は、LDLRタンパク質の量を増加させることにより、対象中のLDLの量を低下させ、対象中の血清コレステロールの低下をもたらす効果を奏し、また、この効果により、高コレステロール血症等の上昇したコレステロールレベルが関連する疾患を治療し、又は予防し、疾患のリスクを低減すること、そのために、LDLRタンパク質と結合することにより、対象中のLDLRタンパク質の量を減少させ、LDLの量を増加させるPCSK9とLDLRタンパク質との結合を中和する抗体又はこれを含む医薬組成物を提供することを課題とするものである(前記(2))。
また、前記(1)及び上記アによれば、本件明細書には、実施例抗体の作製方法として、免疫プログラムの手順及びスケジュールに従った免疫化マウスの作製、免疫化マウスを使用したハイブリドーマの作製、参照抗体と競合する、PCSK9-LDLRとの結合を遮断する抗体を同定するためのスクリーニング及びエピトープビニングアッセイの方法が記載されている。
ところで、EGFaミミック抗体とは、15個のPCSK9のコア残基の大部分を認識する結合中和抗体である。本件明細書の記載によれば、参照抗体である21B12抗体はそのうち6個のアミノ酸残基を、31H4抗体はそのうち3個のアミノ酸残基を認識するに過ぎないから(前記(1)ウ)、参照抗体はいずれもEGFaミミック抗体ではない。また、結合部位対照表に記載されている本件明細書の各実施例抗体は、最大でも8個のアミノ酸残基を認識するにとどまるから(1A12抗体)、これらはいずれもEGFaミミック抗体とはいえない。他に本件明細書の各実施例抗体がEGFaミミック抗体であることを認めるに足りる証拠はない。そうすると、本件明細書には、EGFaミミック抗体が取得できたことが記載されているとはいえない。
当業者が、本件明細書の記載に基づき、一連の手順を最初から繰り返し行うことによって、本件明細書に具体的に記載された参照抗体と競合する中和抗体(ビン1に含まれる21B12抗体と競合する15個の抗体、ビン3に含まれる31H4抗体と競合する7個の抗体)以外に、参照抗体と競合する中和抗体を作製できると仮定しても、A教授の第2鑑定書(乙43)では、「特定のマウスが特定の抗体を生成するかどうかは運に支配されるため、候補となり得る抗体を全て生成しスクリーニングすることは不可能である」とされるところ、この点につき疑義を抱くべき合理的な事情は見当たらない。そうすると、本件明細書記載の抗体の作製過程を経たとしても、免疫化されたマウスの中でPCSK9のどの位置に結合する抗体が得られるかは「運に支配される」ものといえることになる。しかるに、EGFaミミック抗体を含め、特定の位置に結合する抗体を作製する方法が本件特許の出願時における技術常識であったことを認めるに足りる証拠はない。
これらの事情を踏まえると、本件明細書に記載された抗体の作製方法に関する記載をもって、本件明細書の発明の詳細な説明が、本件発明に含まれるEGFaミミック抗体を当業者が作製できるように記載されているということも、また、本件発明に含まれるEGFaミミック抗体が本件明細書の発明の詳細な説明に記載されているということもできない。
そもそも、原告は、本件特許の出願日から約4年後の2012年(平成24年)に至っても、EGFaミミック抗体を取得できていないことを自認している上、EGFaミミック抗体を見つけることは一筋縄ではいかないだろうと述べている(前記(5)ア)。
このように、EGFaミミック抗体は、特許権者が本件出願日の後にあっても取得できておらず、取得困難と認識している抗体である。
以上によれば、本件明細書にはEGFaミミック抗体及びその具体的な作製方法は記載されておらず、当業者において、本件明細書の記載及び本件特許出願当時の技術常識によっては、これを作製できないものと認められる。
したがって、本件発明は、いずれも発明の詳細な説明に記載されたものとはいえず、また、発明の詳細な説明が、その発明の属する技術の分野における通常の知識を有する者がその実施をすることができる程度に明確かつ十分に記載されたものともいえない。すなわち、本件特許は、サポート要件及び実施可能要件に違反し、特許無効審判により無効にされるべきものである。
ウ 原告の主張について
(ア) 原告は、本件優先日又は出願日には、EGFaドメインを模倣する抗体という概念も、EGFaミミック抗体と称する抗体を取得しようという課題も存在せず、我が国の特許制度においては、出願時に存在しない課題について解決手段を提供することまでは求められていないから、出願時に課題として認識されたことのないEGFaミミック抗体が本件明細書に記載されていないとして、サポート要件及び実施可能要件違反とすることはできない旨を主張する。
しかし、原告の主張を前提としても、EGFaミミック抗体の作製という将来解決すべき課題及びその課題解決手段の構成について、本件明細書に記載されておらず、公開されたものといえないにもかかわらず、特許発明として保護することは、発明を公開した代償として特許権を付与するとの特許制度の趣旨・目的に適合せず、相当でない。特許権者である原告でさえも本件発明に含まれるEGFaミミック抗体を取得できない状況にあったことを踏まえると尚更である。
(イ) 原告は、被告がEGFaミミック抗体と称するアリロクマブは、原告が21B12抗体に基づいて開発したエボロクマブと同等の作用効果しか示さず、本件発明の課題の解決において、「大部分のアミノ酸を認識」という技術事項には技術的意義が認められない旨をも主張する。
しかし、LDLRのEGFaドメインを模倣するように、15個のPCSK9のコア残基を多く認識し結合する抗体の方が、完全適合に近くなり、PCSK9のLDLR結合部位を広く覆う形で結合することになるものといえ、PCSK9とLDLRタンパク質の結合を立体的に妨害し、その結合を強く遮断すること、すなわち、PCSK9とLDLRタンパク質の結合を中和する能力が高くなることが期待できる。また、PCSK9のコア残基との結合の数が多ければ、PCSK9と抗体との間の総合的な結合力も強くなり、PCSK9とLDLRタンパク質の結合を中和する能力が高くなることが期待できる。このように、抗体と抗原の関係を論理的にみて、EGFaミミック抗体は、PCSK9とLDLRタンパク質の結合中和活性において、より有利であると考えられる。
また、21B12抗体は、本件発明の抗体そのものではなく、参照抗体であるにとどまる。本件発明には多種多様な抗体が含まれるところ、本件明細書では9C9抗体や3B6抗体が「弱い中和物質」とされていること(【0138】)からもうかがわれるとおり、本件発明に含まれる抗体全てが参照抗体と同等の作用効果を有するわけではない。このため、21B12抗体とアリロクマブ(316P抗体)の比較に基づきEGFaミミック抗体の技術的意義を論じることの意義は乏しい。そもそも、本件メール及び本件プレゼンテーション資料によれば、原告もEGFaミミック抗体を探求していた とみられるのであり、そのことからも、EGFaミミック抗体には十分な技術的意義があることがうかがわれる。
(ウ) さらに、原告は、被告がEGFaミミック抗体と称するアリロクマブは、本件優先日当時から用いられていた一般的な手法により、本件明細書に完全に依拠して作成されたものであり、EGFaミミック抗体が本件明細書の記載から取得できないとはいえない旨をも主張する。
しかし、原告は、本件特許の出願日から約4年後の2012年(平成24年)に至っても、EGFaミミック抗体を取得できていないことを自認している上、EGFaミミック抗体を見つけることは一筋縄ではいかないだろうと述べており、この点のみをもってしても、EGFaミミック抗体の具体的な作製方法が本件明細書に記載されているとはいい難く、また、本件優先日及び出願日当時の技術常識であったともいえない。被告が、EGFaミミック抗体であるアリロクマブ(316P抗体)の産生に当たり本件優先日前から用いられていた一般的な手法を用いていたとしても、「特定のマウスが特定の抗体を生成するかどうかは運に支配されるため、候補となり得る抗体を全て生成しスクリーニングすることは不可能」なものと考えられる以上(前記イ)、そのことをもって、EGFaミミック抗体を作製する具体的な方法が本件優先日及び出願日当時の技術常識として確立していたことを示すものとはいえない。
さらに、証拠(甲8、乙35)及び弁論の全趣旨によれば、316P抗体は、リジェネロンが取得した特許の特許請求の範囲に記載されたものであるところ、本件明細書の公開(2009年(平成21年)2月26日)前であるその第1基礎出願(出願日2008年(平成20年)12月15日)において、試験された抗体の中で最も優れた結合中和活性を示したものと記載されている。このような出願の経緯を踏まえれば、316P抗体が本件明細書に依拠して作成されたものとはいえず、他にこれを認めるに足りる証拠もない。
(エ) その他原告が縷々主張する点を踏まえても、サポート要件及び実施可能要件違反に関する原告の主張は採用できない。
(8) 小括
以上のとおり、本件特許は、サポート要件及び実施可能要件に違反し、特許法36条6項1号及び同条4項1号所定の要件を満たしていない特許出願に対してされたものであり、特許無効審判により無効にされるべきものであるから(同法123条1項4号)、原告は、被告に対し、本件特許権を行使することができない(同法104条5の3第1項)。
・・・
4 まとめ
以上によれば、その余の争点について判断するまでもなく、原告は、被告に対し、本件特許権侵害の不法行為に基づく損害賠償請求権を有しない。
第 4 結論
よって、原告の請求は理由がないから棄却することとして、主文のとおり判決する。
(判決文PDFはこちら)
コメント