<判決紹介>
・平成27年(行ケ)第10113号 審決取消請求事件
・平成28年3月24日判決言渡
・知的財産高等裁判所第3部 鶴岡稔彦、大西勝滋、神谷厚毅
・原告:東和薬品株式会社
・被告:イコス・コーポレイション
・特許4975214(単位製剤)■コメント:
新薬 vs ジェネリックの特許維持審決取消訴訟。
先発品はシアリス錠(タダラフィル)で、後発品はなし。
2013年12月に無効審判請求 → 2015年4月に維持審決 → 同6月に取消訴訟を提起していました。
今回判断されたのは、甲10等に基づいて進歩性があるかどうか。
本件特許の請求項1は下記の通り。「【請求項1】
1日あたり20mgの総用量を上限として,以下の構造式:
【化1】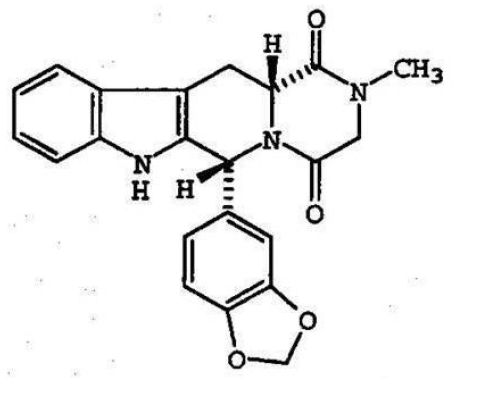
を有する化合物を単位製剤あたり1乃至20mg含み,ヒトにおける勃起不全の処置に使用される内服用単位製剤。」審決が認定した甲10発明、一致点、相違点は下記の通り。「ア 甲10発明
1日あたり0.5~800mgのタダラフィルを単位製剤あたり0.2~400mg含み,ヒトにおける勃起不全の処置に使用される内服用単位製剤
イ 本件発明1と甲10発明との一致点
「タダラフィルを含み,ヒトにおける勃起不全の処置に使用される内服用単位製剤。」の発明である点。
ウ 本件発明1と甲10発明との相違点
(ア) 相違点1本件発明1は,「1日あたり20mgの総用量を上限」とするのに対し,甲10発明は,「1日あたり0.5~800mg」である点。
(イ) 相違点2本件発明1は,「単位製剤あたり1乃至20mg含」むのに対し,甲10発明は,「0.2~400mg含」む点。」審決の理由の要旨はおおよそ下記の通り。・優先権主張の効果が認められ,進歩性判断の基準日は1999年(平成11年)4月26日(判決注・4月30日の明らかな誤記であると認める。)となる。
・本件発明1は甲10等に基づいて,当業者が相違点1に係る構成を容易に着想できたとはいえないし,本件発明1は,甲10記載の発明から予測できない効果も奏しているから,相違点2について検討するまでもなく,本件発明1は,甲10ないし14に記載された発明に基づいて当業者が容易に発明することができたとはいえない。
・実施可能要件、サポート要件を充足する。
・請求項1~13の記載は明確である。裁判所の判断は下記の通り。「第4 当裁判所の判断
事案に鑑み取消事由3から判断する。
1 取消事由3(甲10発明に基づく本件発明1の容易想到性の判断の誤り)について
・・・
(3) 相違点1の容易想到性について
原告は,相違点1に関し,甲10において開示された「0.5~800mg」の範囲内で,甲10の実施例の「50mg」や,同効薬であるシルデナフィルの最も少ない量である「10mg」の用量を参考にして,副作用を考慮し,下限値である「0.5mg」程度といった十分な低用量から始めて,徐々に用量を上げて,薬効と副作用の観点から上限値を定めることは,当業者がごく一般的な臨床試験プロセスの中で容易になし得ることにすぎない旨主張するので,以下検討する。
ア ヒトにおける薬物の用法・用量の決定手法に関する技術常識について
(ア) 甲24(「新医薬品の臨床評価に関する一般指針について」平成4年6月29日薬新薬第43号各都道府県衛生主管部長宛厚生省薬務局新医薬品課長通知)の記載
甲24には以下の記載がある。
a 「臨床試験の目的は,治療薬の疾患又は症候に対する治療的ないし予防的効果や,さらにその使用に際しての危険性や副作用をヒトについて検討し,最終的には治療効果と副作用の相対的評価などに基づいて,臨床における有用性を評価することにある。」(1頁2~4行) b 「ごく初期の臨床試験の目的は,薬効又は副作用の面から投与量を徐々に上げながら決定して行くことである。」(8頁11~12行) c 「最小有効量のみならず,有効で安全な最大値をできるだけ検討し,有効量と安全量の範囲を明らかにしておくことが望ましい。」(10頁4~5行)
d 「3)用法・用量
非臨床試験での全成績を詳細に検討,整理記録し,同効薬,類似構造薬に関する従来の知識,経験をも加味し,ヒトに対し
て十分に安全と見込まれる用量を推定して,初回投与量とする。次に段階的に用量を増し,推定臨床単回投与量を上回るまで単回投与し,用量増加に関連した薬理作用,薬物動態,副作用を調べ,可能ならば有効性の初期徴候を集める。これらの成績に基づいて反復投与量,投与期間を決定する。反復投与試験は,血中濃度が測定可能な治験薬については,血中濃度が定常状態に達するまで行う。血中濃度が測定し得ない治験薬については,臨床における将来の使用状況を推定し,薬効や副作用の出現に注意しながら適切な期間行われるべきである。いわゆる有害反応発現までの用量の範囲を求めることは行い難い状況にあることが少なくないが,その場合には,それまでに得られている非臨床試験成績との関連において,ヒトでの忍容性についての十分な根拠を綿密に検討しておくべきである。」(14頁下から5行~15頁8行)
(イ) 甲64(伊賀立二監修「薬剤予測学入門」,株式会社薬業時報社,平成5年8月31日発行)
a 「■医薬品の用法・用量の科学的設定は,可能であるだろう。 …既にいくつかの同効薬(たとえば,効果発現のレセプター,酵素,イオンチャンネルが共通であることがわかっているもの)があって,別の新たな同効薬(俗にいう「ゾロ新」)の開発をめざす場合を想定して構築されたものである。すなわち…既存の医薬品に関しての前臨床試験の薬効・薬理データ(また場合によっては,一般薬理試験,毒性試験データも利用)と用法・用量設定のための臨床試験データの関係を遡及的に解析することにより,何らかの法則性を見出し,同効薬と考えられる未知の薬物の用法・用量を新たに設定するというものである。」(165頁の標題,165頁13行~166頁2行)
b 「■薬剤予測学において 薬物作用(薬効・薬理作用,副作用・
毒性作用)の評価の位置づけは,研究者の念頭に常に置かれていなければならない。
…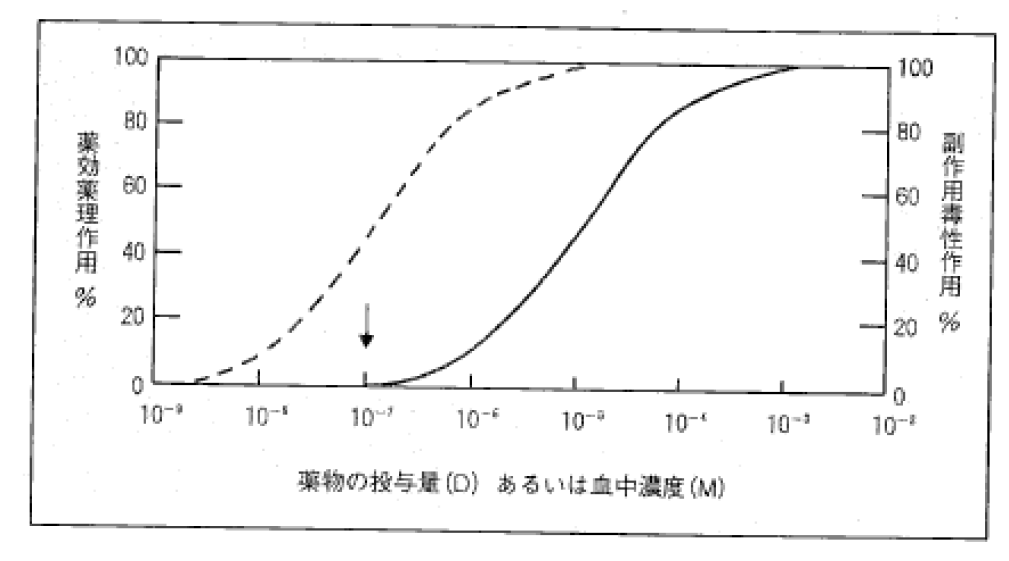
図6–10 最小の副作用の下で最大の薬効・薬理作用を得るための投与設計。
点線は薬効・薬理作用,実線は副作用・毒性作用を示す。最小の副作用で最大の薬理効果を得るためには,たとえば矢印の投与量,血中濃度が至適値ということになる。
…
これらの薬物作用の客観的指標と血中薬物濃度との関係から,最小の副作用の下で最大の薬効・薬理効果を得るための投与設計(用法・用量)が与えられるのである(図6–10)。」(359頁の標題,360頁の図6–10及び17~19行)
(ウ) 前記(ア)及び(イ)によれば,本件優先日当時,研究開発された薬物の臨床における有用性を評価するために,ヒトへ薬物を投与する臨床試験を行うところ,その際の薬物の用法・用量については,非臨床試験での全成績を詳細に検討し,同効薬,類似構造薬に関する従来の知識,経験をも加味し,ヒトに対して十分に安全と見込まれる用量を推定して初回投与量とし,次に段階的に用量を増し,推定臨床単回投与量を上回るまで単回投与して,用量増加に関連した薬理作用,薬物動態,副作用を調べ,これらの成績に基づいて,反復投与量,投与期間を決定し,最小の副作用の下で最大の薬効・薬理効果が得られるような用法・用量の検討を行うことが,技術常識となっていたと認められる。
イ シルデナフィルの薬効,用量,副作用について
(ア) 本件優先日当時,シルデナフィルは,・・・
ウ 相違点1の容易想到性について
加えて,前記(ア)のとおり,甲10のタダラフィルに関するインビトロ試験の結果によれば,タダラフィルのPDE5阻害作用はシルデナフィル(前記イ(ア))に比べ強いことが示されているのであるから,タダラフィルが,インビトロ試験と同様にインビボ試験である臨床試験においても,強いPDE5阻害作用を発揮する可能性を考慮に入れて,タダラフィルの用量としてシルデナフィルの用量である10mg~50mg(前記イ(イ))及びそれよりも若干低い用量を検討することも,当業者において容易に行い得ることである。
以上によれば,甲10発明について,適切な臨床における有用性を評価するために臨床試験を行い,最小の副作用の下で最大の薬効・薬理効果が得られるような範囲として,相違点1に係る範囲を設定することは,当業者が容易に想到することができたものと認められる。
エ 被告の主張について
(ア)被告は,・・・
しかしながら,ヒトに対する適切な用法・用量を決定することに関し,臨床試験においては,前記ア(ウ)のとおり,非臨床試験での全成績を詳細に検討し,同薬効,類似構造薬に関する従来の知識,経験をも加味して決定されるものとされている以上,タダラフィルと同様にPDE5阻害作用を有するシルデナフィルの用量や,タダラフィルのインビトロ試験データを参考にすることも,当業者が当然行うことと認められる。この点につき,タダラフィルの用量の検討に当たり,シルデナフィルは参考にできないほど薬物動態が異なるという知見が存在することをうかがわせる証拠もない。そして,医薬品の開発は,インビトロ試験で有用な薬理効果が確認された化合物について,動物試験,さらにはヒトに対する臨床試験を行い(甲24参照),最適な用量が決定されるものであるが,この過程を経ること自体は,ヒトに医薬品を投与する際の適切な用量を決定するに当たって通常想定されることであって,当業者が容易になし得ることであるから,これらを行う必要があったことを根拠として,医薬品の用量・用法に関する発明につき容易想到性を否定することはできない。このように,前記ウの容易想到性の判断は,甲10に示されたインビトロ試験データから直ちに相違点1の構成を予測できることをいうものではないから,被告の主張は当を得たものとはいえない。
(イ) 被告は,・・・
しかしながら,甲10発明に係るタダラフィルの適切な用量を決定するに当たり,甲10において開示された「毎日0.5~800mgの範囲」の記載や,実施例の「50mg」の製剤例を参考にすること自体は何ら不合理なことではない。そして,インビトロ試験の値からインビボ試験の値を予測する方法や,IC50値やEC50値などのインビトロ試験の値と上記の用量範囲との関連性の記載がなくとも,実施例の50mgも1つの参考値として視野に入れつつ,甲10発明の用量の下限値である0.5mgから段階的に量を増やしていくことにより,相違点1に係る構成に到達することが当業者は容易になし得たことは前記ウのとおりである。
したがって,被告の上記主張は採用することはできない。
・・・
(4) 顕著な効果の判断について
被告は,・・・
ア 薬効について
本件特許明細書の表6(別紙1参照)には,偽薬,タダラフィルを単位用量2mg,5mg,10mg,25mg,50mg,100mgで投与した際の,IIEF勃起機能ドメインのベースラインからの変化の数値(平均±SD(標準偏差))として,それぞれ,0.8±5.3,3.9±6.1,6.6±7.1,7.9±6.7,9.4±7.0,9.8±5.5,8.4±6.1であることが記載されている。また,甲36には,単位用量20mgを投与した際に8.6であったことが示されている。 しかしながら,甲10には,甲10発明に係るタダラフィルが,PDE5阻害剤であって,勃起機能不全の処置に有用であることが記載されているところ,本件特許明細書及び甲36に示された上記の内容は,平均値のみで比較した場合,偽薬から2mgでは3.1,2mgから5mgでは2.7,5mgから10mgでは1.3,10mgから20mgでは0.7,20mgから25mgでは0.8,25mgから50mgでは0.4のそれぞれ増加が示されているのであって,概ね用量が50mgまでの範囲内においては,用量が増加するにつれて薬効が強くなるが,それより用量が増加すると薬効の増加の程度は小さくなるという一般的な知見(甲64,図6–10)に沿う内容を示すものにとどまるし,本件発明1の構成(上限20mgとする構成)を採用したことにより,当該範囲において,薬効の点で格別に顕著な効果を奏することを示すものでもない。
イ 副作用について
(ア) 視覚異常について
・・・
(イ) 顔面紅潮について
・・・
(ウ) 硝酸塩等との併用について
・・・
(エ) その余の副作用について
・・・
また,頭痛,消化不良,背部痛,筋肉痛,結膜炎及び眼瞼浮腫については,それらの副作用が発生し始める単位用量の値はそれぞれ異なるが,2mgから100mgへと単位用量が増加するにつれて発生率が上昇していく傾向が示されており,これは用量が増加するにつれ,副作用が発生する頻度が高まるという副作用の発生傾向に関する一般的な知見(甲64,図6–10)と同様の結果が示されているものであり,上記表7の記載から,これと異なり,本件発明1の構成の範囲において,上記各副作用の低減に格段の効果が存するものとは認められない。なお,・・・
そうすると,本件特許明細書に記載された,頭痛,消化不良,背部痛,筋肉痛,鼻炎,結膜炎及び眼瞼浮腫の副作用の発生率に関しても,本件発明1の構成を採用したことにより,これらの低減につき格別に顕著な効果があるとは認められない。
・・・
ウ 本件審決の判断について
なお,本件審決は,副作用が少ないという点のみならず,本件発明1において「ヒトにおける勃起不全の処置に使用」した際に有効であることが確認されていることが甲10発明から予測できない効果である旨判断している。
しかしながら,前記(3)ア(ウ)の技術常識の存在に照らせば,本件発明1において「ヒトにおける勃起不全の処置に使用」した際に有効であることが確認されたことを予測できない効果であるということはできない。
エ 小括
以上によれば,本件発明1につき,甲10発明から予測できない効果を奏しているとした本件審決の判断には誤りがある。
・・・
2 結論
以上によれば,原告主張の取消事由3は理由があるから,その余の取消事由について判断するまでもなく,本件審決は取り消されるべきものである。
よって,主文のとおり判決する。」なお、審決は相違点1について以下のように判断していました。「これに対し、甲第10号証には臨床試験を行った結果は何も記載されておらず、甲10発明の「0.5~800mg」という範囲に関する一般的な説明(例えば上限値や下限値の導出過程)もなく、PDE5に関するインビトロ試験データ(EC50値等、甲10–10)が記載されているだけにすぎないから、結局、甲第10号証には、タダラフィルをヒトに投与した場合に有効である”可能性”があることが示されている程度にすぎないし、副作用については示唆すらないと認められる。
そうすると、甲第10号証は、タダラフィルをヒトに投与した場合の用量に応じた有効性について何ら予測性を与える情報を提示していないものであり、ましてや、副作用が少なく、かつ、有効な用量範囲が存在することは、甲第10号証から当業者が予測できるものではない。
・・・
そうすると、甲11号証乃至甲第14号証は、いずれもPDE5の選択的な阻害剤による勃起不全の治療に関するものである点で甲第10号証と技術分野が一致しているものの、シルデナフィルに関するものであってタダラフィルに関して何も記載されていないのであるから、仮に、甲10発明と甲11号証乃至甲第14号証に記載された発明を組み合わせる動機付けがあるとしても、タダラフィルの1日あたりの総用量を「1日あたり20mgの総用量を上限」とすることを容易に着想することができたとは言えない。
しかも、「ヒトにおける勃起不全の処置に使用」した際の有効性に関し、甲10発明は、「1日あたりの総用量」が「1日あたり20mgの総用量を上限」である範囲(を含む「0.5~800mg」という範囲のいずれ)において必ずしも有効であるとはいえないのに対し、本件発明1は、「ヒトにおける勃起不全の処置に使用」した際に有効であることが確認されている上に、副作用も少ないという効果を奏する(本件特許明細書の段落【0094】)のであるから、本件発明1は、甲10発明から予測できない効果も奏していると認められる。
そうすると、相違点2について検討するまでもなく、本件発明1は、甲第10乃至14号証に記載された発明に基づいて当業者が容易に発明をすることができたとはいえない。」比べるとなかなか面白いですね。
裁判所にはできれば優先権主張の方も判断してほしかったですが。 ☆☆☆
判決文はこちらから

コメント