・令和2年(行ケ)第10081号 審決取消請求事件(第2事件)
・令和3年12月27日判決言渡
・知的財産高等裁判所第4部 菅野雅之 本吉弘行 岡山忠広
・第1事件原告兼第2事件被告:大塚製薬株式会社
・第1事件被告兼第2事件原告:Meiji Seika ファルマ株式会社
・第1事件被告:大原薬品工業株式会社
・特許4178032
・発明の名称:5-HT1A受容体サブタイプ作動薬
大塚製薬(第1事件原告)は、エビリファイ(一般名:アリピプラゾール)の用途特許である特許4178032の特許権者です。
Meiji Seika ファルマ(第1事件被告)は、2018年11月12日に無効審判を請求し、2020年5月12日に一部無効審決(請求項1、4、5は無効、請求項2は請求不正立)が出ていました。
今回、大塚製薬は、請求項1、4、5に係る部分の取消しを求める第1事件訴訟を提起しました。
前回ブログのリリカ用途特許もそうでしたが、今回も医薬用途発明の実施可能要件、サポート要件が争点になっています。
本件特許の請求項1、2、4、5(訂正後)は以下の通りです。
【請求項1】
鬱病,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害からなる群から選ばれた5-HT1A受容体サブタイプに関連した中枢神経系の障害を治療するための医薬組成物であって,式(1):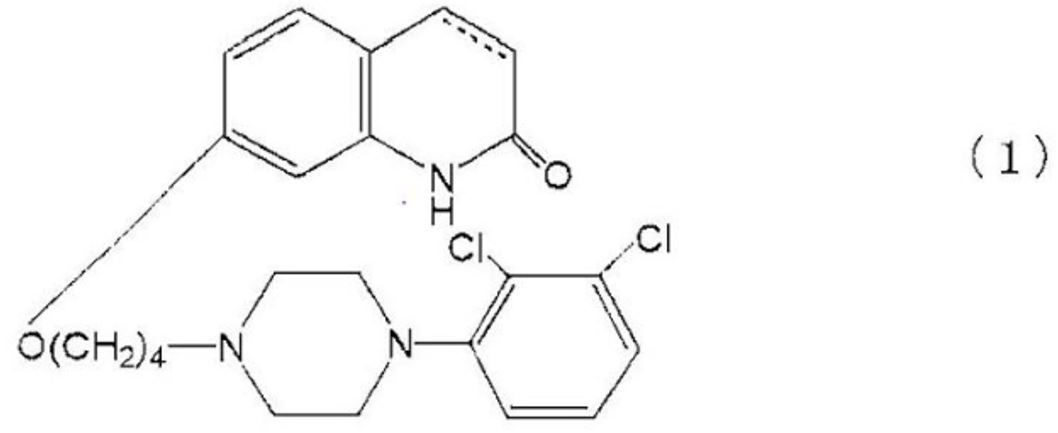 (カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
【請求項2】
5-HT1A受容体サブタイプに関連した中枢神経系の障害である鬱病を治療するための医薬組成物であって,式(1): (カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
【請求項4】
障害が,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害である,請求項1記載の医薬組成物。
【請求項5】
障害が,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害である,請求項1記載の医薬組成物。
知財高裁は、審決の判断の前提(5-HT1A部分作動薬を双極性障害のうつ病エピソードの治療に使用できることが技術常識であるとはいえない)に誤りがあると判断しました。鬱病,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害からなる群から選ばれた5-HT1A受容体サブタイプに関連した中枢神経系の障害を治療するための医薬組成物であって,式(1):
 (カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
【請求項2】
5-HT1A受容体サブタイプに関連した中枢神経系の障害である鬱病を治療するための医薬組成物であって,式(1):
 (カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
【請求項4】
障害が,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害である,請求項1記載の医薬組成物。
【請求項5】
障害が,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害である,請求項1記載の医薬組成物。
そして、前提に誤りがあることを理由に、請求項1、4、5が実施可能要件及びサポート要件を満たさないと判断した審決の部分を取り消しました。
また、その判断を行う前の検討において、どのような場合に、医薬用途発明の「その物の使用する行為」としての「実施」をすることができるかについて説明されてます。
特に、患者に投与したときの「有害事象が生じる危険性」が論点になっていて、参考になります。
判決抜粋を以下に記載しておきます。
判決
第4 当裁判所の判断
・・・
⑵ 本件出願当時の5-HT 1A受容体部分作動薬の抗うつ作用に関する技術常識について
ア 前記⑴アの記載事項を総合すると,本件出願当時,①セロトニン(5HT)が脳内のシナプス後5-HT 1A受容体に結合することにより,5-HT 1A受容体が活性化し,神経伝達を促進(増強)し,抗うつ作用を奏すること,うつ状態の時は,セロトニンの量が減少していると考えられていたこと,5-HT 1A受容体作動薬(5-HT 1A 系薬物)がうつ病の治療に用いられる薬物の一つとして挙げられていたことなどから,5-HT 1A受容体作動薬は,抗うつ作用を有するものと考えられていたこと,②5-HT1A受容体作動薬(完全作動薬又は部分作動薬)であるタンドスピロン,ゲピロン,ブスピロン及びイプサピロン並びにこれらと化学構造の異なる化合物が抗うつ作用を有することを立証した臨床試験及び非臨床試験の結果が多数報告されていること,③臨床試験の段階で脱落して抗うつ薬として発売されるまでに至らなかった5-HT 1A受容体部分作動薬があるが,5-HT 1A受容体部分作動薬が抗うつ作用を有すること自体は否定されておらず,5-HT 1A受容体部分作動薬の臨床開発は続けられていたことが認められる。
上記認定事実によれば,本件出願当時,5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することは技術常識であったことが認められる。
そうすると,本件出願当時,5-HT 1A受容体部分作動薬一般が上記5-HT 1A受容体部分作動作用に基づく抗うつ作用によりうつ病に対して治療効果を有することは技術常識であったことが認められる。
イ これに対し被告Meijiは,①本件出願当時,5-HT 1A受容体への部分作動作用を有するが,抗うつ作用を示さない化合物があること(1-(2-ピリミジル)ピペラジン(1-PP),mCPP,S-15535)が知られており,5-HT 1A受容体への部分作動作用があれば抗うつ作用があるということはできない,②抗うつ効果の予測可能性は,5-HT受容体に対する選択又は非選択の違いにより異なり,複数の受容体に作用する非選択的な抗うつ薬の場合,主たるターゲットとする受容体以外への作用を通じて,抗うつ効果が減殺されることがあることが知られていた(例えば,本件出願当時,ドパミンD 2 受容体拮抗作用は,抗うつ薬の抗うつ効果を減殺し,5-HT 1A受容体作動作用は,5-HT 2A受容体(5-HT 2受容体)作動作用によって減殺される。),③5-HT 1A受容体は,シナプス前後に局在し,各受容体の機能・作用機序は異なることが知られており,このため,ある化合物に抗うつ作用が期待できるか否かは,シナプス前後のアゴニスト作用の強弱・バランスにも依存するとされていた,④「アザピロン系」と総称されるタンドスピロン,ゲピロン,ブスピロン及びイプサピロンは,いずれも「選択的な」5-HT1A 作動薬であるのに対し,本件カルボスチリル化合物に相当するアリピプラゾールは,5-HT 1A受容体のみならず,ドパミンD 2 ,D 3 受容体,5-HT 2A受容体にも結合する「非選択的な」5-HT 1A 部分作動薬であり,アザピロン系化合物と本件カルボスチリル化合物とは,化学構造が全く異なることからすると,タンドスピロン,ゲピロン,ブスピロン及びイプサピロンに関する報告をもって,5-HT 1A受容体に対する「非選択的な」作動薬であるとともに,完全作動薬ではなく部分作動薬にすぎない本件カルボスチリル化合物が抗うつ作用を示すことを理解する根拠とすることはできない,⑤5-HT 1A部分作動薬については,臨床試験の段階で脱落して抗うつ薬として発売されるまでに至らず,5-HT 1A 部分作動薬が有する抗うつ効果がどれくらい強力であるかについて懐疑的な研究者もいたというのであるから,本件出願時には,5-HT 1A 作動薬の鬱病治療に対する有用性について,「5-HT 1A 作動薬は鬱病に対して効果を有する可能性が示唆される(治療効果を示すかもしれないし,示さないかもしれない)」という程度の認識があったにすぎず,5-HT 1A 作動薬の鬱病治療に対する有用性について,当業者間でもコンセンサスが得られていなかったとみるのが自然であるなどとして,「5-HT1A部分作動薬を鬱病の治療に使用することができること」が本件出願時の技術常識であったとはいえない旨主張する。
しかしながら,①ないし③については,本件出願当時,5-HT 1A受容体への部分作動作用を有するが,抗うつ作用を示さない化合物があること,アザピロン系化合物であるタンドスピロン,ゲピロン,ブスピロン及びイプサピロンと本件カルボスチリル化合物は,化学構造が異なり,アリピプラゾールは,5-HT 1A受容体のみならず,ドパミンD 2 ,D 3 受容体,5-HT 2A受容体にも結合すること,複数の受容体に作用する抗うつ薬の場合,主たるターゲットとする受容体以外への作用を通じて,抗うつ効果が減殺されることがあることが知られていたこと,ある化合物に抗うつ作用が期待できるか否かは,シナプス前後のアゴニスト作用の強弱・バランスにも依存するとされていたことは,5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することが本件出願当時の技術常識であったことを否定する根拠になるものとはいえない。
また,④については,そもそも5-HT 1A受容体に対する「選択的な作動薬」と「非選択的な」作動薬の区別自体に明確な基準があるものとはいえず,タンドスピロン,ゲピロン,ブスピロン及びイプサピロンに関する報告をもって,5-HT 1A受容体に対する「非選択的な」作動薬であるとともに,完全作動薬ではなく部分作動薬にすぎない本件カルボスチリル化合物が抗うつ作用を示すことを理解する根拠とすることはできないとはいえない。
さらに,⑤については,本件出願当時,5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することは技術常識であったのであるから,5-HT 1A受容体部分作動薬一般が上記5-HT 1A受容体部分作動作用に基づく抗うつ作用によりうつ病に対して治療効果を有することは技術常識であったものと認めるのが相当であり,採用することができない。
したがって,被告Meijiの上記主張は,採用することができない。
(3)本件出願当時の5-HT 1A受容体部分作動薬の双極性障害のうつ病エピソードに対する治療効果に関する技術常識について
ア 前記⑴イの記載事項を総合すると,本件出願当時,①大うつ病(単極性うつ病)の症状の一つである「大うつ病エピソード」(うつ病エピソード)と双極性障害(双極性障害Ⅰ型及びⅡ型)の症状の一つである「大うつ病エピソード」(うつ病エピソード)の定義及び診断基準は同一であったこと,②大うつ病性障害の患者に有効であることが立証されているすべての抗うつ薬は双極性障害のうつ病エピソードの患者にも有効であると考えられていたこと,③一方で,双極性障害の患者に対する抗うつ薬の投与によって,躁病エピソードを誘発し,躁転や急速交代化を引き起こす可能性があるが,このような可能性がある場合には,抗うつ薬の投与量の調整,気分安定薬との併用等により対応していたことが認められる。
上記認定事実と5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって発現する5-HT 1A受容体部分作動作用に基づいて抗うつ作用を有することは,本件出願当時の技術常識であったこと(前記(2))によれば,本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することは技術常識であったことが認められる。
イ この点に関し本件審決は,本件出願時において,各種の抗うつ薬を双極性障害の「うつ病エピソード」の治療に使用することができることは,技術常識であるが,一方で,双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等の様々な有害事象が生じる危険性があることを考慮すると,全ての抗うつ薬が双極性障害の「うつ病エピソード」の治療に使用することができるという技術常識があるとは言い難く,5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえないなどとして,5-HT1A部分作動薬を双極性障害の治療に使用することができることは,本件出願時の技術常識であるとはいえない旨判断した。
(ア)ところで,医薬品の開発は,基礎研究として対象疾患の治療の標的分子(受容体等)を探索し,標的分子(受容体等)に対する薬理作用及び当該薬理作用を有する化合物を探索する薬理試験(in vitro 試験,動物実験)が実施され,このような薬理試験の結果として,化合物が有する薬理作用が疾患に対する治療効果を有すること(「医薬の有効性」)について合理的な期待が得られた段階で医薬用途発明の特許出願がされるのが一般的であるものと認められる。
一方で,薬機法は,医薬品の製造販売をしようとする者は,その品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない旨規定し(14条1項),その承認審査においては,申請に係る医薬品の名称,成分,分量,用法,用量,効能,効果,副作用その他の品質,有効性及び安全性に関する事項を審査し,その審査の結果,申請に係る医薬品又は医薬部外品が,その申請に係る効能又は効果を有すると認められないとき,申請に係る医薬品が,その効能又は効果に比して著しく有害な作用を有することにより,医薬品又は医薬部外品として使用価値がないと認められるときは,承認を与えない旨規定し(同条2項3号),厚生労働省令で定める医薬品の承認を受けようとする者は,申請書に,厚生労働省令で定める基準に従って収集され,かつ,作成された臨床試験の試験成績に関する資料その他の資料を添付して申請しなければならない旨規定している(同条3項)。この臨床試験は,臨床試験第1相(少数の健常人に対する投与であり,副作用などの有無をみる。),臨床試験第2相(少数の患者に対する投与であり,効果などが見込まれるかをみる。),臨床試験第3相(多数の患者に対する投与であり,効果などがあることを確認する。)の3段階の試験で実施される。このように医薬品の承認審査では,申請に係る化合物の薬効及び安全性(副作用,有害事象の有無及び程度等)を総合的に考慮し,「医薬の有用性」について審査している。
以上のような医薬品の開発の実情,医薬品の承認審査制度の内容,特許法の記載要件(実施可能要件,サポート要件)の審査は,先願主義の下で,発明の保護及び利用を図ることにより,発明を奨励し,もって産業の発達に寄与するとの特許法の目的を踏まえてされるべきものであることに鑑みると,物の発明である医薬用途発明について「その物の使用する行為」としての「実施」をすることができるというためには,当該医薬をその医薬用途の対象疾患に罹患した患者に対して投与した場合に,著しい副作用又は有害事象の危険が生ずるため投与を避けるべきことが明白であるなどの特段の事由がない限り,明細書の発明の詳細な説明の記載及び特許出願時の技術常識に基づいて,当該医薬が当該対象疾患に対して治療効果を有することを当業者が理解できるものであれば足りるものと解するのが相当である。
これを本件についてみるに,本件審決が述べる「双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等」の「様々な有害事象が生じる危険性」については,本件出願当時,抗うつ薬と気分安定薬とを併用することにより,躁転のリスクコントロールが可能であり,躁転発生時には抗うつ薬の中止又は漸減により対応可能であると考えられていたこと(前記ア③)に照らすと,上記特段の事由に当たるものと認められない。
そして,本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することが技術常識であったことは,前記ア認定のとおりである。
(イ)以上によれば,本件審決の前記判断は誤りである。
ウ この点に関し被告らは,双極性障害については,鬱病相と躁病相があり,双極性障害の鬱病相を治療するために抗鬱薬を投与すると,躁転の可能性を有意に高め,双極性障害の症状を悪化させる可能性が高いという固有の事情が存在し(甲A1,2,31の1,乙A98,106,),臨床上も,双極性障害の鬱病相の治療において抗鬱薬の使用は慎重に行うべきとされていることからすれば,全ての抗鬱薬を双極性障害の鬱病相(うつ病エピソード)の治療に用いることができるなどという技術常識は存在しない旨主張する。
しかしながら,前記イで説示したところに照らすと,被告ら主張の上記固有の事情があるとしても,本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することが技術常識であったことを否定する根拠にならない。
したがって,被告らの上記主張は採用することができない。
・・・
6 取消事由1-1(本件発明1,4及び5に係る実施可能要件の判断の誤り)(第1事件関係)について
⑴ 本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することは技術常識であったことは,前記3⑶認定のとおりである。
また,本件明細書の発明の詳細な説明の開示事項(前記1(2))から,本件発明1の本件カスボスチリル化合物は,5-HT 1A受容体部分作動薬であることを理解できる。
そうすると,本件明細書に接した当業者は,本件明細書の発明の詳細な説明記載のアリピプラゾールの薬理学的試験(in vitro試験)の結果(前記1(2)ウ)及び上記技術常識に基づいて,5-HT 1A 受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害又は双極性II型障害の「うつ病エピソード」を発症した患者に対して本件カスボスチリル化合物を投与して,当該「うつ病エピソード」を治療できることを理解できるものと認められる。
したがって,これを否定して,本件発明1,4及び5が実施可能要件に適合しないとした本件審決の判断は,その前提において誤りがある。
・・・
7 取消事由1-2(本件発明1,4及び5に係るサポート要件の判断の誤り)(第1事件関係)について
本件審決は,①「5-HT1A部分作動薬を双極性障害の治療に使用することができること」が本件出願当時の技術常識であるとはいえないのであるから,技術常識を参酌して上記薬理学的試験(in vitro 試験)の結果を見ても,本件カルボスチリル化合物を,5-HT1A受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害及び双極性II型障害のいずれかに罹患した者に投与して,本件カルボスチリル化合物が有する5-HT1A部分作動作用に基づいて,これらの対象疾患を治療できることを,当業者が認識できるとはいえない,②したがって,技術常識を参酌しても,本件発明1により,5-HT 1A 受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害及び双極性II型障害のいずれかに罹患した患者を治療するという課題を解決できることを,当業者が認識できるとはいえないから,本件発明1,4及び5は,本件明細書の発明の詳細な説明に記載したものであるとはいえず,サポート要件に適合しない旨判断した。
しかしながら,本件審決の上記判断は,本件明細書の発明の詳細な説明記載のアリピプラゾールの薬理学的試験(in vitro 試験)の結果(前記1(2)ウ)及び本件出願当時の技術常識に基づいて,5-HT 1A 受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害又は双極性II型障害の「うつ病エピソード」を発症した患者に対して本件カスボスチリル化合物を投与して,当該「うつ病エピソード」を治療できることを理解できること(前記3⑶)を否定して判断したものであるから,その前提において誤りがある。これに反する被告らの主張は採用することができない。
したがって,本件審決のうち,本件発明1,4及び5に係る部分を取り消すことが相当である。
第5 結論
以上のとおり,第1事件の原告主張の取消事由はいずれも理由があるから,本件審決のうち,本件発明1,4及び5に係る部分は取り消されるべきであり,第2事件の被告Meiji主張の取消事由はいずれも理由がないから,被告Meijiの請求は棄却すべきものである。
・・・
⑵ 本件出願当時の5-HT 1A受容体部分作動薬の抗うつ作用に関する技術常識について
ア 前記⑴アの記載事項を総合すると,本件出願当時,①セロトニン(5HT)が脳内のシナプス後5-HT 1A受容体に結合することにより,5-HT 1A受容体が活性化し,神経伝達を促進(増強)し,抗うつ作用を奏すること,うつ状態の時は,セロトニンの量が減少していると考えられていたこと,5-HT 1A受容体作動薬(5-HT 1A 系薬物)がうつ病の治療に用いられる薬物の一つとして挙げられていたことなどから,5-HT 1A受容体作動薬は,抗うつ作用を有するものと考えられていたこと,②5-HT1A受容体作動薬(完全作動薬又は部分作動薬)であるタンドスピロン,ゲピロン,ブスピロン及びイプサピロン並びにこれらと化学構造の異なる化合物が抗うつ作用を有することを立証した臨床試験及び非臨床試験の結果が多数報告されていること,③臨床試験の段階で脱落して抗うつ薬として発売されるまでに至らなかった5-HT 1A受容体部分作動薬があるが,5-HT 1A受容体部分作動薬が抗うつ作用を有すること自体は否定されておらず,5-HT 1A受容体部分作動薬の臨床開発は続けられていたことが認められる。
上記認定事実によれば,本件出願当時,5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することは技術常識であったことが認められる。
そうすると,本件出願当時,5-HT 1A受容体部分作動薬一般が上記5-HT 1A受容体部分作動作用に基づく抗うつ作用によりうつ病に対して治療効果を有することは技術常識であったことが認められる。
イ これに対し被告Meijiは,①本件出願当時,5-HT 1A受容体への部分作動作用を有するが,抗うつ作用を示さない化合物があること(1-(2-ピリミジル)ピペラジン(1-PP),mCPP,S-15535)が知られており,5-HT 1A受容体への部分作動作用があれば抗うつ作用があるということはできない,②抗うつ効果の予測可能性は,5-HT受容体に対する選択又は非選択の違いにより異なり,複数の受容体に作用する非選択的な抗うつ薬の場合,主たるターゲットとする受容体以外への作用を通じて,抗うつ効果が減殺されることがあることが知られていた(例えば,本件出願当時,ドパミンD 2 受容体拮抗作用は,抗うつ薬の抗うつ効果を減殺し,5-HT 1A受容体作動作用は,5-HT 2A受容体(5-HT 2受容体)作動作用によって減殺される。),③5-HT 1A受容体は,シナプス前後に局在し,各受容体の機能・作用機序は異なることが知られており,このため,ある化合物に抗うつ作用が期待できるか否かは,シナプス前後のアゴニスト作用の強弱・バランスにも依存するとされていた,④「アザピロン系」と総称されるタンドスピロン,ゲピロン,ブスピロン及びイプサピロンは,いずれも「選択的な」5-HT1A 作動薬であるのに対し,本件カルボスチリル化合物に相当するアリピプラゾールは,5-HT 1A受容体のみならず,ドパミンD 2 ,D 3 受容体,5-HT 2A受容体にも結合する「非選択的な」5-HT 1A 部分作動薬であり,アザピロン系化合物と本件カルボスチリル化合物とは,化学構造が全く異なることからすると,タンドスピロン,ゲピロン,ブスピロン及びイプサピロンに関する報告をもって,5-HT 1A受容体に対する「非選択的な」作動薬であるとともに,完全作動薬ではなく部分作動薬にすぎない本件カルボスチリル化合物が抗うつ作用を示すことを理解する根拠とすることはできない,⑤5-HT 1A部分作動薬については,臨床試験の段階で脱落して抗うつ薬として発売されるまでに至らず,5-HT 1A 部分作動薬が有する抗うつ効果がどれくらい強力であるかについて懐疑的な研究者もいたというのであるから,本件出願時には,5-HT 1A 作動薬の鬱病治療に対する有用性について,「5-HT 1A 作動薬は鬱病に対して効果を有する可能性が示唆される(治療効果を示すかもしれないし,示さないかもしれない)」という程度の認識があったにすぎず,5-HT 1A 作動薬の鬱病治療に対する有用性について,当業者間でもコンセンサスが得られていなかったとみるのが自然であるなどとして,「5-HT1A部分作動薬を鬱病の治療に使用することができること」が本件出願時の技術常識であったとはいえない旨主張する。
しかしながら,①ないし③については,本件出願当時,5-HT 1A受容体への部分作動作用を有するが,抗うつ作用を示さない化合物があること,アザピロン系化合物であるタンドスピロン,ゲピロン,ブスピロン及びイプサピロンと本件カルボスチリル化合物は,化学構造が異なり,アリピプラゾールは,5-HT 1A受容体のみならず,ドパミンD 2 ,D 3 受容体,5-HT 2A受容体にも結合すること,複数の受容体に作用する抗うつ薬の場合,主たるターゲットとする受容体以外への作用を通じて,抗うつ効果が減殺されることがあることが知られていたこと,ある化合物に抗うつ作用が期待できるか否かは,シナプス前後のアゴニスト作用の強弱・バランスにも依存するとされていたことは,5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することが本件出願当時の技術常識であったことを否定する根拠になるものとはいえない。
また,④については,そもそも5-HT 1A受容体に対する「選択的な作動薬」と「非選択的な」作動薬の区別自体に明確な基準があるものとはいえず,タンドスピロン,ゲピロン,ブスピロン及びイプサピロンに関する報告をもって,5-HT 1A受容体に対する「非選択的な」作動薬であるとともに,完全作動薬ではなく部分作動薬にすぎない本件カルボスチリル化合物が抗うつ作用を示すことを理解する根拠とすることはできないとはいえない。
さらに,⑤については,本件出願当時,5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することは技術常識であったのであるから,5-HT 1A受容体部分作動薬一般が上記5-HT 1A受容体部分作動作用に基づく抗うつ作用によりうつ病に対して治療効果を有することは技術常識であったものと認めるのが相当であり,採用することができない。
したがって,被告Meijiの上記主張は,採用することができない。
(3)本件出願当時の5-HT 1A受容体部分作動薬の双極性障害のうつ病エピソードに対する治療効果に関する技術常識について
ア 前記⑴イの記載事項を総合すると,本件出願当時,①大うつ病(単極性うつ病)の症状の一つである「大うつ病エピソード」(うつ病エピソード)と双極性障害(双極性障害Ⅰ型及びⅡ型)の症状の一つである「大うつ病エピソード」(うつ病エピソード)の定義及び診断基準は同一であったこと,②大うつ病性障害の患者に有効であることが立証されているすべての抗うつ薬は双極性障害のうつ病エピソードの患者にも有効であると考えられていたこと,③一方で,双極性障害の患者に対する抗うつ薬の投与によって,躁病エピソードを誘発し,躁転や急速交代化を引き起こす可能性があるが,このような可能性がある場合には,抗うつ薬の投与量の調整,気分安定薬との併用等により対応していたことが認められる。
上記認定事実と5-HT 1A受容体部分作動薬が,脳内のシナプス後5-HT 1A受容体に結合することによって発現する5-HT 1A受容体部分作動作用に基づいて抗うつ作用を有することは,本件出願当時の技術常識であったこと(前記(2))によれば,本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することは技術常識であったことが認められる。
イ この点に関し本件審決は,本件出願時において,各種の抗うつ薬を双極性障害の「うつ病エピソード」の治療に使用することができることは,技術常識であるが,一方で,双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等の様々な有害事象が生じる危険性があることを考慮すると,全ての抗うつ薬が双極性障害の「うつ病エピソード」の治療に使用することができるという技術常識があるとは言い難く,5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえないなどとして,5-HT1A部分作動薬を双極性障害の治療に使用することができることは,本件出願時の技術常識であるとはいえない旨判断した。
(ア)ところで,医薬品の開発は,基礎研究として対象疾患の治療の標的分子(受容体等)を探索し,標的分子(受容体等)に対する薬理作用及び当該薬理作用を有する化合物を探索する薬理試験(in vitro 試験,動物実験)が実施され,このような薬理試験の結果として,化合物が有する薬理作用が疾患に対する治療効果を有すること(「医薬の有効性」)について合理的な期待が得られた段階で医薬用途発明の特許出願がされるのが一般的であるものと認められる。
一方で,薬機法は,医薬品の製造販売をしようとする者は,その品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない旨規定し(14条1項),その承認審査においては,申請に係る医薬品の名称,成分,分量,用法,用量,効能,効果,副作用その他の品質,有効性及び安全性に関する事項を審査し,その審査の結果,申請に係る医薬品又は医薬部外品が,その申請に係る効能又は効果を有すると認められないとき,申請に係る医薬品が,その効能又は効果に比して著しく有害な作用を有することにより,医薬品又は医薬部外品として使用価値がないと認められるときは,承認を与えない旨規定し(同条2項3号),厚生労働省令で定める医薬品の承認を受けようとする者は,申請書に,厚生労働省令で定める基準に従って収集され,かつ,作成された臨床試験の試験成績に関する資料その他の資料を添付して申請しなければならない旨規定している(同条3項)。この臨床試験は,臨床試験第1相(少数の健常人に対する投与であり,副作用などの有無をみる。),臨床試験第2相(少数の患者に対する投与であり,効果などが見込まれるかをみる。),臨床試験第3相(多数の患者に対する投与であり,効果などがあることを確認する。)の3段階の試験で実施される。このように医薬品の承認審査では,申請に係る化合物の薬効及び安全性(副作用,有害事象の有無及び程度等)を総合的に考慮し,「医薬の有用性」について審査している。
以上のような医薬品の開発の実情,医薬品の承認審査制度の内容,特許法の記載要件(実施可能要件,サポート要件)の審査は,先願主義の下で,発明の保護及び利用を図ることにより,発明を奨励し,もって産業の発達に寄与するとの特許法の目的を踏まえてされるべきものであることに鑑みると,物の発明である医薬用途発明について「その物の使用する行為」としての「実施」をすることができるというためには,当該医薬をその医薬用途の対象疾患に罹患した患者に対して投与した場合に,著しい副作用又は有害事象の危険が生ずるため投与を避けるべきことが明白であるなどの特段の事由がない限り,明細書の発明の詳細な説明の記載及び特許出願時の技術常識に基づいて,当該医薬が当該対象疾患に対して治療効果を有することを当業者が理解できるものであれば足りるものと解するのが相当である。
これを本件についてみるに,本件審決が述べる「双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等」の「様々な有害事象が生じる危険性」については,本件出願当時,抗うつ薬と気分安定薬とを併用することにより,躁転のリスクコントロールが可能であり,躁転発生時には抗うつ薬の中止又は漸減により対応可能であると考えられていたこと(前記ア③)に照らすと,上記特段の事由に当たるものと認められない。
そして,本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することが技術常識であったことは,前記ア認定のとおりである。
(イ)以上によれば,本件審決の前記判断は誤りである。
ウ この点に関し被告らは,双極性障害については,鬱病相と躁病相があり,双極性障害の鬱病相を治療するために抗鬱薬を投与すると,躁転の可能性を有意に高め,双極性障害の症状を悪化させる可能性が高いという固有の事情が存在し(甲A1,2,31の1,乙A98,106,),臨床上も,双極性障害の鬱病相の治療において抗鬱薬の使用は慎重に行うべきとされていることからすれば,全ての抗鬱薬を双極性障害の鬱病相(うつ病エピソード)の治療に用いることができるなどという技術常識は存在しない旨主張する。
しかしながら,前記イで説示したところに照らすと,被告ら主張の上記固有の事情があるとしても,本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することが技術常識であったことを否定する根拠にならない。
したがって,被告らの上記主張は採用することができない。
・・・
6 取消事由1-1(本件発明1,4及び5に係る実施可能要件の判断の誤り)(第1事件関係)について
⑴ 本件出願当時,5-HT 1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することは技術常識であったことは,前記3⑶認定のとおりである。
また,本件明細書の発明の詳細な説明の開示事項(前記1(2))から,本件発明1の本件カスボスチリル化合物は,5-HT 1A受容体部分作動薬であることを理解できる。
そうすると,本件明細書に接した当業者は,本件明細書の発明の詳細な説明記載のアリピプラゾールの薬理学的試験(in vitro試験)の結果(前記1(2)ウ)及び上記技術常識に基づいて,5-HT 1A 受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害又は双極性II型障害の「うつ病エピソード」を発症した患者に対して本件カスボスチリル化合物を投与して,当該「うつ病エピソード」を治療できることを理解できるものと認められる。
したがって,これを否定して,本件発明1,4及び5が実施可能要件に適合しないとした本件審決の判断は,その前提において誤りがある。
・・・
7 取消事由1-2(本件発明1,4及び5に係るサポート要件の判断の誤り)(第1事件関係)について
本件審決は,①「5-HT1A部分作動薬を双極性障害の治療に使用することができること」が本件出願当時の技術常識であるとはいえないのであるから,技術常識を参酌して上記薬理学的試験(in vitro 試験)の結果を見ても,本件カルボスチリル化合物を,5-HT1A受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害及び双極性II型障害のいずれかに罹患した者に投与して,本件カルボスチリル化合物が有する5-HT1A部分作動作用に基づいて,これらの対象疾患を治療できることを,当業者が認識できるとはいえない,②したがって,技術常識を参酌しても,本件発明1により,5-HT 1A 受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害及び双極性II型障害のいずれかに罹患した患者を治療するという課題を解決できることを,当業者が認識できるとはいえないから,本件発明1,4及び5は,本件明細書の発明の詳細な説明に記載したものであるとはいえず,サポート要件に適合しない旨判断した。
しかしながら,本件審決の上記判断は,本件明細書の発明の詳細な説明記載のアリピプラゾールの薬理学的試験(in vitro 試験)の結果(前記1(2)ウ)及び本件出願当時の技術常識に基づいて,5-HT 1A 受容体サブタイプに関連した中枢神経系の障害である,請求項1に記載の双極性I型障害又は双極性II型障害の「うつ病エピソード」を発症した患者に対して本件カスボスチリル化合物を投与して,当該「うつ病エピソード」を治療できることを理解できること(前記3⑶)を否定して判断したものであるから,その前提において誤りがある。これに反する被告らの主張は採用することができない。
したがって,本件審決のうち,本件発明1,4及び5に係る部分を取り消すことが相当である。
第5 結論
以上のとおり,第1事件の原告主張の取消事由はいずれも理由があるから,本件審決のうち,本件発明1,4及び5に係る部分は取り消されるべきであり,第2事件の被告Meiji主張の取消事由はいずれも理由がないから,被告Meijiの請求は棄却すべきものである。

コメント