・令和3年12月24日判決言渡
・東京地方裁判所民事第29部 國分隆文 小川暁 佐々木亮
・原告:ワーナー-ランバート カンパニー リミテッド ライアビリティー カンパニー
・被告:小林化工株式会社
・特許3693258
・発明の名称:イソブチルGABAまたはその誘導体を含有する鎮痛剤
ワーナー-ランバート(原告)は、特許3693258の特許権者です。特許3693258はプレガバリン(販売名:リリカカプセル25mg、75mg、150mg)(処分の対象となった物)の製造販売承認に基づいて特許権存続期間の延長登録がされています。延長後の存続期間満了日は2022年7月16日です。
ワーナー-ランバートは、ファイザーに対し本件特許権に係る専用実施権を設定しており、ファイザーはリリカカプセル、リリカOD錠を販売しています。効能・効果は「神経障害性疼痛、線維筋痛症に伴う疼痛」です。
一方で、2017年1月16日に特許3693258に対する無効審判(請求人:沢井製薬、参加人:15社)が請求され、2020年7月14日に一部無効審決(請求項1、2は無効)が出ています。これに伴い、2020年8月17日に小林化工(被告)を含む22社のリリカ後発品が製造販売承認され、その後発売されました。
一部無効審決は下記ブログで紹介しています(その後、審決取消訴訟の判決が出ましたので後日ブログにアップします)。

<リリカ特許の無効審判> 医薬用途の訂正及び実施可能要件・サポート要件が認められなかった審決例
審決紹介
・審判番号:無効2017-800003
・審判請求日:2017/01/16
・審決日:2020/07/14
・審判官:滝口尚良 穴吹智子 井上典之
・請求人:沢井製薬 株式会社
・参加人:日新製薬 株式会社等
・...
本訴訟は、ワーナー-ランバートが、小林化工に対し、プレガバリンOD錠25mg「KN」等の製造等が特許3693258の特許権を侵害していると主張して、製造販売等の差止め及びその廃棄を求めた事案です。
本件特許の特許査定時の請求項1~4は以下のとおりです。
【請求項1】
式I
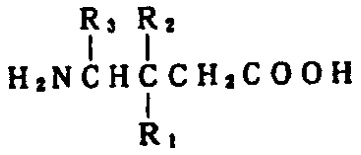
(式中、R1は炭素原子1~6個の直鎖状または分枝状アルキルであり、R2は水素またはメチルであり、R3は水素、メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩、ジアステレオマー、もしくはエナンチオマーを含有する痛みの処置における鎮痛剤。
【請求項2】
化合物が、式IにおいてR3およびR2はいずれも水素であり、R1は-(CH2)0-2-iC4H9である化合物の(R)、(S)、または(R,S)異性体である請求項1記載の鎮痛剤。
【請求項3】
化合物が、(S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸である請求項1記載の鎮痛剤。
【請求項4】
痛みが炎症性疼痛、神経障害による痛み、癌による痛み、術後疼痛、幻想肢痛、火傷痛、痛風の痛み、骨関節炎の痛み、三叉神経痛の痛み、急性ヘルペスおよびヘルペス後の痛み
、カウザルギーの痛み、特発性の痛み、または線維筋痛症である請求項1記載の鎮痛剤。
請求項1、2について、東京地裁は以下のように判断しました。式I
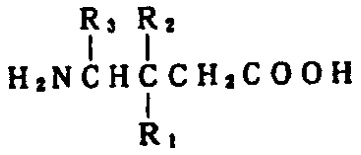
(式中、R1は炭素原子1~6個の直鎖状または分枝状アルキルであり、R2は水素またはメチルであり、R3は水素、メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩、ジアステレオマー、もしくはエナンチオマーを含有する痛みの処置における鎮痛剤。
【請求項2】
化合物が、式IにおいてR3およびR2はいずれも水素であり、R1は-(CH2)0-2-iC4H9である化合物の(R)、(S)、または(R,S)異性体である請求項1記載の鎮痛剤。
【請求項3】
化合物が、(S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸である請求項1記載の鎮痛剤。
【請求項4】
痛みが炎症性疼痛、神経障害による痛み、癌による痛み、術後疼痛、幻想肢痛、火傷痛、痛風の痛み、骨関節炎の痛み、三叉神経痛の痛み、急性ヘルペスおよびヘルペス後の痛み
、カウザルギーの痛み、特発性の痛み、または線維筋痛症である請求項1記載の鎮痛剤。
・請求項1、2の発明(訂正前の「痛み」)は実施可能要件とサポート要件を満たさない。
・請求項1、2の訂正(下記)は、新規事項の追加のため認められない。
(×)請求項1:痛覚過敏又は接触異痛の痛み
(×)請求項2:神経障害又は繊維筋痛症による、痛覚過敏又は接触異痛の痛みの処置における
次に、請求項3、4については、上記の審決で下記の用途への訂正が確定しています。
(○)請求項3:炎症を原因とする痛み、又は手術を原因とする痛みの処置における鎮痛剤
(○)請求項4:炎症性疼痛による痛覚過敏の痛み、又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における鎮痛剤
請求項3、4について、東京地裁は以下のように判断しました。
・請求項3、4について、文言侵害、均等侵害は成り立たない。
広い医薬用途特許が権利化できても、それだけでは十分ではないことがあるっていうことですね。
上記の無効審決もそうですが、実務の参考になる重要な判決ですね。
最後に、判決抜粋を以下に記載しておきます。
判決
第4 当裁判所の判断
・・・
2 本件発明1及び2について
(1)争点1-1(実施可能要件違反の成否)について
ア 実施可能要件違反の判断基準について
いわゆる医薬用途発明においては,一般に,当業者にとって,物質名,化学構造等が示されることのみによっては,当該用途の有用性及びそのための当該医薬の有効量を予測することは困難であり,当該発明に係る医薬を当該用途に使用することができないから,そのような発明において実施可能要件を満たすためには,明細書の発明の詳細な説明に,薬理データの記載又はこれと同視し得る程度の記載をすることなどにより,当該用途の有用性及びそのための当該医薬の有効量を裏付ける記載を要するものと解するのが相当である。
本件発明1及び2の特許請求の範囲においては,本件化合物が「痛みの処置における」(構成要件1B)「鎮痛剤」(構成要件1C)及び「鎮痛剤」(構成要件2C)として作用することが記載されているところ,いずれも本件化合物の鎮痛効果が認められる痛みは特定されていない。しかし,本件明細書には,本件化合物について,「痛みの処置とくに慢性の疼痛性障害の処置における使用方法である。このような障害にはそれらに限定されるものではないが炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群が包含される。」(前記1(1)イ)と記載されていることに照らすと,本件発明1及び2は,本件化合物が少なくとも上記各痛みに対して鎮痛効果を有することを内容とするものと解される。
したがって,本件発明1及び2について実施可能要件を満たすというためには,本件明細書の発明の詳細な説明に,薬理データの記載又はこれと同視し得る程度の記載をすることなどにより,上記各痛みに対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載が必要であるというべきである。
イ 痛みの分類及び機序について
(ア)痛みの分類及び機序について,証拠(甲15の1,甲26,39,41,42,46,55,59,77ないし84,86,88,乙3ないし9)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)aないしgの文献の記載によれば,痛みは,その機序により大きく分けると,①炎症や組織損傷による侵害レセプターへの刺激により生じる侵害受容性疼痛,②末梢神経又は中枢神経が圧迫されたり,絞扼されたり,遮断されたりすることにより生じる神経障害性疼痛,③直接末梢からの侵害刺激がないにもかかわらず存在し,心因性のもので,特発性疼痛とも呼ばれる心因性疼痛の3つに分類することがすることができること,線維筋痛症は,上記③の心因性疼痛に分類されること,上記のとおりに分類された痛みの中にも様々なものがあり,それぞれの痛みについて機序や症状,治療方法が存在することが,本件出願当時,技術常識であったと認めるのが相当である。
(ウ)これに対して,原告は,痛覚過敏及び接触異痛は,通常の痛みとは異なり,末梢性感作や中枢性感作による神経の機能異常で生じる痛みであると主張し,その根拠として,本件出願当時に前記(ア)hないしlのとおりの文献が存在したことを指摘する。
しかし,前記(ア)h,i,k及びlの各文献は,マスタードオイル,カプサイシン及び切開による侵害刺激を与える実験の結果に基づくものであるから,これらの実験により,痛覚過敏及び接触異痛が,その原因にかかわらず,末梢性感作や中枢性感作による神経の機能異常により生じると,直ちにいうことはできない。
また,前記(ア)jの文献では,「NメチルDアスパラギン酸(NMDA)受容体の過剰活性は,神経障害性疼痛の発生における要因の1つである可能性がある。」,「動物の神経障害性疼痛モデルにおいて示唆されるように…,痛覚過敏は NMDA 受容体によって介在される「ワインドアップ現象」の提示である可能性がある。」などと記載されているところ,これらの記載は,NMDA受容体の過剰活性が神経障害性疼痛の要因となること,あるいは痛覚過敏がNMDA受容体によって介在されるワインドアップ現象(神経細胞の感作)によるものであることの可能性を指摘したにすぎず,これをもって,上記文献の記載内容が本件出願当時の技術常識であったということはできない。
そして,他に,本件出願当時,痛覚過敏及び接触異痛がその原因にかかわらず末梢性感作や中枢性感作による神経の機能異常で生じる痛みであることが技術常識であったと認めるに足りる的確な証拠はない。
したがって,原告の上記主張は採用することができない。
(エ)原告は,神経障害性疼痛は神経系の一次的な損傷あるいはその機能異常が原因となって生じた疼痛であり,線維筋痛症は痛覚過敏や接触異痛を伴う慢性疼痛症候群であると定義されるところ,神経障害性疼痛及び線維筋痛症に伴う痛覚過敏や接触異痛はいずれも神経細胞の感作により生じるものであると主張し,その根拠として,本件出願当時に前記(ア)mないしrのとおりの文献が存在したことを指摘する。
しかし,前記(ア)mの文献においては,線維筋痛症を痛覚過敏を伴う慢性疼痛症候群と定義する例があることが紹介されているものの,それは線維筋痛症の具体的な原因について言及するものではないし,痛覚過自体,前記(ウ)のとおり,その原因にかかわらず神経細胞の感作により生じるものであることが本件出願当時に技術常識であったとは認められない。また,上記文献は,線維筋痛症に「中枢性感作があること,および圧痛点が二次痛覚過敏を示すことも示唆される。」と記載するにとどまっており,上記文献の記載内容が本件出願当時の技術常識であったとは認め難い。
前記(ア)nの文献は,・・・。
そして,他に,本件出願当時,神経障害性疼痛及び線維筋痛症に伴う痛覚過敏及び接触異痛が神経細胞の感作により生じるものであったことが技術常識であったことを認めるに足りる的確な証拠はない。
したがって,原告の上記主張は採用することができない。
(オ)原告は,痛覚過敏及び接触異痛がその原因にかかわらず末梢や中枢の神経細胞の感作により生じることや,神経障害性疼痛及び線維筋痛症に伴う痛覚過敏や接触異痛がいずれも神経細胞の感作により生じることについて,専門家の意見書(甲67,68,124,125)を提出する。
しかし,上記の各意見書は,いずれも本件出願後に作成されたものであり,前記(ウ)及び(エ)のとおり,それらの記載内容を裏付け得る本件出願当時の技術常識に関する文献が存在するとは認められないから,いずれも採用することができない。
ウ ホルマリン試験について
(ア)本件明細書には,本件化合物に係るホルマリン試験の結果が記載されているところ,ホルマリン試験について,証拠(甲27,43,45ないし51,64)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)の各文献の記載によれば,本件出願当時,ホルマリンを皮下注射することにより二相の侵害応答が引き起こされ,そのうち後期相は炎症を反映した持続する疼痛であるところ,ホルマリン試験はこれら二相の侵害応答に対する薬剤の鎮痛効果を確かめる動物モデル試験であり,NSAIDは後期相において鎮痛効果を生じることが,技術常識であったと認められる。
そして,前記イ(イ)のとおりに痛みが分類されることや,NSAIDが一般的に侵害受容性疼痛に対して有効であると考えられており,神経障害性疼痛や線維筋痛症に対して有効であるとは考えられていなかったこと(甲123)を併せ考えると,ホルマリン試験の後期相は,侵害受容性疼痛に対する薬剤の鎮痛効果を確認するための試験と認めるのが相当である。
本件明細書には,「CI-1008」((S)-3-(アミノメチル)-5-メチルヘキサン酸であり(甲2),構成要件3Aを充足する本件化合物の一種である。)及び「3-アミノメチル-5-メチル-ヘキサン酸」(構成要件3A)がホルマリン試験の後期相において有効であったと記載されていること(前記1(1)エ)からすると,本件出願当時,本件明細書のホルマリン試験の結果に接した当業者は,本件化合物について,侵害受容性疼痛としての持続する疼痛に対して有効であると理解し,その他の痛みに対して有効であると理解することはなかったというべきである。
・・・
エ カラゲニン試験について
(ア)本件明細書には,本件化合物に係るカラゲニン試験の結果が記載されているところ,カラゲニン試験について,証拠(甲44,56,57,146)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)の各文献の記載によれば,本件出願当時,カラゲニン試験とは,カラゲニンにより炎症を誘発し,痛覚過敏の状態を引き起こして,これに対する薬剤の効果を確かめる試験であることが,技術常識であったと認められる。
そして,本件明細書には,本件化合物の一種である「CI-1008」(前記ウ(イ))がカラゲニン試験において有効であったことが記載されており,さらに,「これらのデータはギャバペンチンおよび CI-1008 が炎症性疼痛の処置に有効であることを示す。」(前記1(1)オ)との記載がある。
以上によれば,本件出願当時,本件明細書のカラゲニン試験の結果に接した当業者は,本件化合物について,侵害受容性疼痛としての痛覚過敏に対して有効であると理解し,その他の痛みに対して有効であると理解することはなかったというべきである。
・・・
オ 術後疼痛試験について
(ア)本件明細書には,本件化合物に係る術後疼痛試験の結果が記載されているところ,術後疼痛試験について,証拠(甲15の1,甲58)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)の各文献の記載によれば,本件出願当時,術後疼痛試験は,ラットの皮膚,筋膜及び足蹠の足底側面の筋肉を切開することにより,痛覚過敏を引き起こし,これに対する薬剤の効果を確かめる試験であることが,技術常識であったと認められる。
そして,本件明細書には,「S-(+)-3-イソブチルギャバ」(構成要件3Aを充足する本件化合物の一種である(甲9)。)が術後疼痛試験において有効であったことが記載されており,さらに,「ラット足蹠筋肉の切開は熱痛覚過敏および接触異痛を生じた。いずれの侵害受容反応も手術後1時間以内にピークに達し,3日間維持された。実験期間中,動物はすべて良好な健康状態を維持した。」(前記1(1)キ(キ)),「ここに掲げた結果はラット足蹠筋肉の切開は少なくとも3時間続く熱痛覚過敏および接触異痛を誘発することを示している。本試験の主要な所見は,ギャバペンチンおよびS-(+)-3-イソブチルギャバがいずれの侵害受容反応の遮断に対しても等しく有効なことである。」(同(コ))との記載がある。
以上によれば,本件出願当時,本件明細書の術後疼痛試験の結果に接した当業者は,本件化合物について,侵害受容性疼痛としての熱痛覚過敏及び接触異痛に対して有効であると理解し,その他の痛みに対して有効であると理解することはなかったというべきである。
・・・
カ その他の原告の主張について
・・・
キ 小括
以上によれば,本件明細書の発明の詳細な説明においては,ホルマリン試験,カラゲニン試験及び術後疼痛試験の各薬理データの記載により,本件化合物が侵害受容性疼痛に分類される痛みに対して鎮痛効果があること及びそのための当該医薬の有効量が裏付けられているものの,本件発明1及び2がその内容とする「痛み」,すなわち,少なくとも「炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群」(前記1(1)イ)の各痛みに対して鎮痛効果があること 及びそのための当該医薬の有効量を裏付ける記載 がないから,本件発明1及び2は,実施可能要件に違反する。
(2)争点1-2(サポート要件違反の成否)について
ア 特許請求の範囲の記載が明細書のサポート要件(法36条6項1号)に適合するか否かは,特許請求の範囲の記載と発明の詳細な説明の記載とを対比し,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か,また,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきものである。
イ 本件発明1及び2の特許請求の範囲において,本件化合物が「痛みの処置における」(構成要件1B)「鎮痛剤」(構成要件1C)又は「鎮痛剤」(構成要件2C)として作用することが記載されているところ,前記(1)アのとおり,本件明細書の記載に照らせば,上記各構成要件の記載は,本件化合物が少なくとも「炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群」の各痛みに対して鎮痛効果を有することを規定したものと解される。
そして,本件明細書の記載(前記1(1)ウ)によれば,本件発明1及び2は,少なくとも上記各痛みに対して,市場にある鎮痛剤,例えば,麻薬性鎮痛剤やNSAIDでは不十分な効果しか得られず,また,これらの鎮痛剤には副作用があるため,不完全な処置しか行われていなかったことから,上記各痛みに対する鎮痛効果が高く,副作用の少ない鎮痛剤を提供することを課題とし,この課題を解決しようとしたものであると認められる。
しかし,前記(1)キのとおり,本件明細書の発明の詳細な説明には,本件化合物について,上記各痛みのうち,侵害受容性疼痛に分類される痛みに対して鎮痛効果があることの記載はあるものの,その余の痛みに対して鎮痛効果があることについての記載があるとは認められない。
したがって,本件明細書の発明の詳細な説明の記載は,当業者が,本件発明1及び2の上記課題の解決,すなわち少なくとも上記各痛みの全てに対して鎮痛効果を有することを認識できる範囲のものとはいえず,また,当業者が本件出願当時の技術常識に照らして上記各痛みに対して鎮痛効果を有することを認識できる範囲のものともいえないから,本件発明1及び2は,サポート要件に違反する。
ウ これに対して,原告は,サポート要件を充足するといえるためには,明細書に接した当業者が技術常識も踏まえて課題が解決できるであろうとの合理的期待が得られれば足り,明細書に基づき追試や分析をすることによって更なる技術の発展に資することができれば足りると主張する。
しかし,明細書は,発明の技術内容を一般に開示するとともに,特許権として成立した後にその効力の及ぶ範囲(特許発明の技術的範囲)を明らかにするという役割を有するものであるから,サポート要件に適合するというためには,前記アのとおり,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものである必要があるというべきである。
そして,前記イのとおり,本件明細書に接した当業者は,本件出願当時の技術常識を踏まえても,本件発明1及び2で鎮痛効果を有するとされる各痛みに対して鎮痛効果を生じると認識することができたとはいえない。
したがって,原告の上記主張は採用することができない。
(3)争点1-3(本件訂正が訂正要件を満たすか)について
ア 請求項2に係る本件訂正について
請求項2に係る本件訂正のうち,「鎮痛剤」(構成要件2C)を「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤」(構成要件2B’及び2C)と訂正する点について,形式上は,特許請求の範囲を減縮するものといえる。
しかし,前記(1)キのとおり,本件明細書の発明の詳細な説明には,本件化合物について,侵害受容性疼痛に対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載があるものの,その他の痛みに対して鎮痛効果があることなどを裏付ける記載があるとはいえない。そして,前記(1)イ(イ)によれば,「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」とは,侵害受容性疼痛ではなく,神経障害性疼痛又は心因性疼痛に分類されるものである。
したがって,上記訂正は,神経障害性疼痛又は心因性疼痛の処置における鎮痛剤という新規事項を追加するものであって,本件明細書に記載した事項の範囲内においてされたものではないので,訂正要件を満たすとは認められない(法134条の2第9項,126条5項)。
イ 請求項1に係る本件訂正について
本件訂正前の請求項2は請求項1を引用しており,これらは一群の請求項を構成する。そして,請求項2に係る本件訂正は,当該請求項についての訂正が認められるときは請求項1とは別の訂正単位として扱われることを求めるものである。しかし,前記アのとおり,請求項2に係る本件訂正は認められないから,請求項1と請求項2は依然として一群の請求項を構成していることになり,請求項1に係る本件訂正も認められない(法134条の2第3項)。
(4)小括
以上によれば,その余の点を判断するまでもなく,本件発明1及び2については,実施可能要件違反及びサポート要件違反が認められるから,無効の抗弁は理由があり,請求項1及び請求項2に係る本件訂正は訂正要件に違反するものであるから,訂正の再抗弁は理由がない。
したがって,延長登録により存続期間が延長された本件特許権の効力が被告医薬品に及ぶか否かにかかわらず,原告の被告に対する本件発明1及び2に基づく被告医薬品の製造,販売及び販売の申出の差止請求並びに被告医薬品の廃棄請求は,いずれも理由がない。
3 本件発明3及び4について
(1)争点2-1(文言侵害の成否)について
ア 被告医薬品の構成要件3Bの充足性について
(ア)本件発明3の特許請求の範囲及び本件明細書の各記載
a 本件発明3の特許請求の範囲には,「炎症を原因とする痛み,又は手術を原因とする痛みの処置における」(構成要件3B)「鎮痛剤」(構成要件3C)との記載がある。
b 本件明細書には,「発明の背景」として,「本発明は,痛みの治療において鎮痛/抗痛覚過敏作用を発揮する化合物としてのグルタミン酸およびγ-アミノ酪酸(GABA)の類縁体の使用である。」(前記1(1)ア)との記載があり,「発明の概要」として,「本発明は,以下の式Ⅰの化合物の,痛みの処置とくに慢性の疼痛性障害の処置における使用方法である。このような障害にはそれらに限定されるものではないが炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群が包含される。」(前記1(1)イ)との記載があり,「発明の詳述」として,「本発明は,上記式Ⅰの化合物の上に掲げた痛みの処置における鎮痛剤としての使用方法である。痛みにはとくに炎症性疼痛,神経障害の痛み,癌の痛み,術後疼痛,および原因不明の痛みである特発性疼痛たとえば幻想肢痛が包含される。」(前記1(1)ウ)との記載がある。
また,本件明細書には,構成要件3Aを充足する本件化合物の一種である「CI-1008」及び「S-(+)-3-イソブチルギャバ」(前記2(1)ウ(イ),オ(イ))について,ホルマリン試験,カラゲニン試験及び術後疼痛試験を実施し,鎮痛効果があったことが記載されている(前記1(1)エ,オ及びキ)。
(イ)本件訂正の経緯
証拠(甲3,4,18,21,乙1,2)によれば,本件訂正の経緯について,以下の事実を認めることができる。
a 特許庁は,本件無効審判事件において,平成31年2月28日付けで,① 本件明細書の発明の詳細な説明の記載は,ホルマリン試験,カラゲニン試験及び術後疼痛試験の結果に基づき,本件化合物が本件訂正前発明4記載の各痛みを初めとする種々の種類の痛みの治療に有効であることを当業者に認識させようとするものであること,② 本件明細書のホルマリン試験及びカラゲニン試験の結果の記載を見た当業者であれば,本件化合物が本件訂正前発明4記載の「炎症性疼痛」の処置における鎮痛効果を有すると認識することができ,術後疼痛試験の結果の記載を見た当業者であれば,本件化合物が本件訂正前発明4記載の「術後疼痛」の処置における鎮痛効果を有すると認識できること,③ 痛みには本件訂正前発明4記載の各痛みを含む種々のものがあり,その原因や病態生理も様々であることは,本件出願当時の技術常識であり,鎮痛剤であればあらゆる種類の痛みに有効であるというわけではないことも,本件出願当時の技術常識であったこと,④ 当業者は,本件明細書のホルマリン試験,カラゲニン試験及び術後疼痛試験の結果の記載に接しても,本件発明1及び2並びに本件訂正前発明3及び4に係る鎮痛剤が「炎症性疼痛」及び「術後疼痛」以外の本件訂正前発明4記載の各痛みの処置における鎮痛効果を有することを認識することができないから,本件明細書の発明の詳細な説明の記載は,本件発明1及び2並びに本件訂正前発明3及び4を実施することができる程度に明確かつ十分に記載されたものとはいえないこと,⑤ 本件明細書の発明の詳細な説明に接した当業者が,本件発明1及び2並びに本件訂正前発明3及び4により,本件訂正前発明4記載の各痛みを含む痛みの処置をすることができる鎮痛剤を提供するという課題を解決できると認識できるとはいえないから,本件訂正前発明1ないし4は,本件明細書の発明の詳細な説明に記載されたものではないことを理由として,本件特許は平成14年法律第24号による改正前の法36条4項,法36条6項1号に規定する各要件を満たさず,法123条1項4号により無効とすべきものである旨の本件審決予告をした(甲21,乙2)。
b 原告は,前記aの本件審決予告を受け,令和元年7月1日付けで,本件発明1及び2並びに本件訂正前発明3及び4を前記前提事実(3)イのとおりに訂正する本件訂正をした(甲3,4)。
さらに,原告は,同年8月7日付けの手続補正書により本件訂正に係る訂正請求書を補正したところ,補正後の訂正請求書の訂正の理由では,① 請求項3に係る本件訂正について,「炎症を原因とする痛み,又は手術を原因とする痛みの処置における」との記載により,鎮痛剤の処置対象となる痛みを限定するものであるところ,本件明細書に記載されたカラゲニン試験では,カラゲニンを用いて炎症を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用い,また,術後疼痛試験では,手術を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用いていることなどからすると,本件明細書等に記載された事項の範囲内のものであること,② 請求項4に係る本件訂正について,訂正前の請求項4においては炎症性疼痛から線維筋痛症までの13項目の痛みが選択的に記載されていたものを,「炎症性疼痛」及び「術後疼痛」のみを残し,その他の選択肢を削除するとともに,「炎症性疼痛」については,これによって生じる痛みのうち鎮痛剤の処置対象とする痛みを,「による痛覚過敏の」との記載により痛覚過敏に特定し,「術後疼痛」については,これによって生じる痛みのうち鎮痛剤の処置対象とする痛みを,「による痛覚過敏若しくは接触異痛の」との記載により痛覚過敏又は接触異痛に特定することによって限定するものであるところ,本件明細書に記載されたホルマリン試験では,ホルマリンを用いた侵害刺激の後期相(痛覚過敏及び接触異痛)の処置に本件化合物を用い,カラゲニン試験では,カラゲニンを用いて炎症を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用い,また,術後疼痛試験では,手術を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用いていることなどからすると,本件明細書等に記載された事項の範囲内のものであることが記載されていた(甲4)。
c また,原告は,本件訂正とともに,令和元年7月1日付けで,① 本件訂正発明1及び2について,本件明細書に記載されたホルマリン試験,カラゲニン試験及び術後疼痛試験により,これらの鎮痛剤が痛覚過敏又は接触異痛の痛みに対して効果を奏することが明確に確認されており,当業者は,痛覚過敏や接触異痛等の原因となる神経の機能異常が原因の疼痛である神経障害性疼痛や痛覚過敏を伴う疼痛である線維筋痛症に対しても効果を奏すると理解するので,実施可能要件及びサポート要件を満たすこと,② 本件発明3及び4について,本件審決予告において実施可能要件及びサポート要件を満たすと判断された「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定するものであるから,実施可能要件及びサポート要件を満たすことを記載したことを記載した上申書を提出した(甲18,乙1)。
(ウ)構成要件3Bの充足性
a 前記(ア)の本件発明3に係る特許請求の範囲及び本件明細書の記載を総合すると,構成要件3Bの「炎症を原因とする痛み」及び「手術を原因とする痛み」とは,それぞれ本件明細書における「炎症性疼痛」及び「術後疼痛」を意味するものと理解できる。
そして,前記(ア)bのとおり,本件明細書には,構成要件3Aを充足する「CI-1008」及び「S-(+)-3-イソブチルギャバ」について,ホルマリン試験,カラゲニン試験及び術後疼痛試験において鎮痛効果があったことが記載されているところ,前記2(1)ウないしオのとおり,ホルマリン試験,カラゲニン試験及び術後疼痛試験は侵害受容性疼痛としての痛覚過敏,接触異痛等に対する鎮痛効果を検証するための試験であることが本件出願当時の技術常識であったから,本件明細書において動物モデル試験により本件化合物の鎮痛効果が検証されたのは,侵害受容性疼痛のみであったと理解できる。
さらに,前記(イ)のとおり,本件審決予告において,痛みには本件訂正前発明4記載の各痛みを含む種々のものがあり,鎮痛剤であればあらゆる種類の痛みに有効であるというわけではないところ,本件明細書からは,「炎症性疼痛」及び「術後疼痛」以外の本件訂正前発明4記載の各痛みに対して鎮痛効果を有することを認識することはできな いと指摘されたことを受けて,原告は,本件訂正を行い,鎮痛剤の処置対象となる痛みを,本件審決予告において実施可能要件及びサポート要件を満たすと判断された「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定したと説明したものである。
以上の本件発明3に係る特許請求の範囲及び本件明細書の記載の解釈並びに本件訂正の経緯等によれば,構成要件3Bの「炎症を原因とする痛み」及び「手術を原因とする痛み」とは,侵害受容性疼痛である炎症性疼痛及び術後疼痛を意味し,これら以外の痛みを含むものではないと解するのが相当である。
b 前記前提事実(5)アのとおり,被告医薬品は,効能・効果を神経障害性疼痛及び線維筋痛症に伴う疼痛とする疼痛治療剤であり,「炎症を原因とする痛み」及び「手術を原因とする痛み」の鎮痛剤であるとは認められないから,構成要件3Bを充足するとは認められない。
(エ)原告の主張について
a 原告は,本件明細書のカラゲニン試験や術後疼痛試験により,神経細胞の感作により生じる神経障害性疼痛や線維筋痛症に伴う疼痛等の慢性疼痛に共通する痛覚過敏や接触異痛に対する効果が確認されたので,本件発明3の技術的範囲には,神経の病変や疾患,損傷が関与するか否かにかかわらず,炎症や手術によって生じる痛覚過敏や接触異痛の全てが含まれると主張する。
しかし,前記2(1)イ(エ)のとおり,本件出願当時,痛覚過敏及び接触異痛が,その原因にかかわらず,神経細胞の感作により生じる痛みであることが技術常識であったとは認められない。
また,前記2(1)エ及びオのとおり,本件明細書に記載されたカラゲニン試験及び術後疼痛試験により,本件化合物について,侵害受容性疼痛としての痛覚過敏や接触異痛に対する鎮痛効果が確かめられたものであって,痛みの原因にかかわらず痛覚過敏や接触異痛に対する鎮したがって,原告の上記主張は採用することができない。
b 原告は,神経障害性疼痛や線維筋痛症に伴う疼痛は侵害受容性疼痛との混合性疼痛とされるところ,被告医薬品はこのような混合性疼痛を生じた患者の痛みの処置に用いられるから,本件発明3の技術的範囲が侵害受容性疼痛に限られるか否かにかかわらず,また,侵害受容性疼痛の定義とは無関係に,被告医薬品の鎮痛の対象は「炎症を原因とする痛み,又は手術を原因とする痛み」(構成要件3B)を充足すると主張する。
しかし,前記2(1)カ(イ)のとおり,本件出願当時,痛みは侵害受容性疼痛,神経障害性疼痛及び心因性疼痛に大別されたところ,侵害受容性疼痛である炎症性疼痛や術後疼痛が生じると必ず神経障害性疼痛や心因性疼痛である線維筋痛症に伴う痛みを生じるということが技術常識であったとは認められず,これらの痛みを併発することがあったとしても,当業者が,これらを一つの混合性疼痛として理解し,侵害受容性疼痛に対して有効である鎮痛剤が神経障害性疼痛又は心因性疼痛に対しても有効であり,神経障害性疼痛又は心因性疼痛に対して有効である鎮痛剤が侵害受容性疼痛に対しても有効であると認識していたとは認められない。
また,前記(ウ)のとおり,「炎症を原因とする痛み」及び「手術を原因とする痛み」とは侵害受容性疼痛である炎症性疼痛及び術後疼痛を意味し,本件発明3に係る特許請求の範囲及び本件明細書の各記載を見ても,これらが炎症又は手術を原因として生じた神経障害性疼痛や線維筋痛症に伴う疼痛をも含むと理解することはできず,このような解釈が本件出願当時の技術常識であったことを認めるに足りる証拠もない。
したがって,原告の上記主張は採用することができない。
c 原告は,① 本件訂正の前後を問わず,カラゲニン試験や術後疼痛試験により神経障害性疼痛や線維筋痛症に伴う疼痛に対する本件化合物の効果を確認することができると一貫して主張してきたものであり,② 本件審決予告は,神経障害性疼痛や線維筋痛症に伴う疼痛のうちカラゲニン試験や術後疼痛試験の痛みに含まれる部分についてまで本件化合物の効果を確認することができないとまでは判断していないと主張する。
しかし,上記①について,証拠(甲18,19)によれば,原告は,本件訂正後も,カラゲニン試験や術後疼痛試験により,本件化合物が神経障害性疼痛や線維筋痛症に伴う疼痛に対して鎮痛効果を有することを確認することができるなどと主張していることが認められるが,前記前提事実(3)のとおり,請求項1及び2に係る本件訂正においては,請求項3及び4に係る本件訂正とは異なり,鎮痛の対象を「痛覚過敏又は接触異痛の痛み」及び「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」としていたものである。そして,前記(イ)のとおり,本件審決予告は,本件明細書に記載されたカラゲニン試験及び術後疼痛試験の結果を見た当業者は,炎症性疼痛及び術後疼痛の処置において鎮痛効果を有すると認識し,これら以外の痛みの処置において鎮痛効果を有すると認識することはできないから,本件特許には実施可能要件違反及びサポート要件違反が認められると指摘し,これを受けて,原告は,請求項3及び4に係る本件訂正を行い,これによって請求項3及び4の「痛み」を本件審決予告において実施可能要件及びサポート要件を満たすと判断された「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定するものであると説明した。そうすると,請求項3及び4との関係においては,原告は,本件化合物の鎮痛の対象を「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定する意図であったことは明らかである。
また,上記②については,本件審決予告における上記の指摘に照らし,本件審決予告が神経障害性疼痛や線維筋痛症に伴う疼痛のうちカラゲニン試験及び術後疼痛試験により鎮痛効果を確認することができる部分が存在することを前提としていないことは明らかである。
したがって,原告の上記各主張はいずれも採用することができない。
イ 被告医薬品の構成要件4Bの充足性について
本件発明4の特許請求の範囲には,「炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における」(構成要件4B)「鎮痛剤」(構成要件4C)との記載がある。
そして,前記ア(ウ)によれば,構成要件4Bの「炎症性疼痛」及び「術後疼痛」とは,構成要件3Bの「炎症を原因とする痛み」及び「手術を原因とする痛み」と同様に,侵害受容性疼痛である炎症性疼痛及び術後疼痛を意味し,本件訂正前発明4記載の「神経障害による痛み」及び「線維筋痛症」は含まないと解するのが相当である。
そうすると,前記前提事実(5)アのとおり,被告医薬品は,効能・効果を神経障害性疼痛及び線維筋痛症に伴う疼痛とする疼痛治療剤であり,「炎症性疼痛」及び「術後疼痛」の鎮痛剤であるとは認められないから,構成要件4Bを充足するとは認められない。
(2)争点2-2(均等侵害の成否)について
ア 被告医薬品が本件発明3の構成と均等なものであるかについて
(ア)原告は,本件発明3は,慢性疼痛に対する画期的処方薬として,抗てんかん作用を有するGABA類縁体を痛みの処置に用いることを見いだしたものであり,その本質的部分は本件化合物を慢性疼痛の処置に用いる点にあるから,対象となる痛みが侵害受容性疼痛か,神経障害性疼痛や線維筋痛症かは本質的部分ではなく,効能・効果を神経障害性疼痛や線維筋痛症に伴う疼痛とし,慢性疼痛の処置に用いる鎮痛剤である被告医薬品は,均等侵害の第1要件を満たすと主張する。
しかし,前記1(1)アのとおり,本件特許に係る発明は,てんかん,ハンチントン舞踏病等の中枢性神経系疾患に対する抗発作療法等に有用な薬物である本件化合物が,痛みの治療における鎮痛作用及び抗痛覚過敏作用を有し,反復使用により耐性を生じず,モルヒネと交叉耐性がないことに着目した医薬用途発明であるところ,前記2(1)イのとおり,本件出願当時,痛みには種々のものがあり,その原因や機序も様々であることが技術常識であった。
そうすると,いかなる痛みに対して鎮痛効果を有するかは,本件発明3において本質的部分というべきであり,その鎮痛効果の対象を異にする被告医薬品は,本件発明3の本質的部分を備えているものと認めることはできない。したがって,本件発明3に係る特許請求の範囲に記載された構成中の被告医薬品と異なる部分が本件発明3の本質的部分でないということはできないから,被告医薬品は均等の第1要件を満たさない。
(イ)また,前記(1)アによれば,原告は,本件訂正前発明3においては鎮痛の対象となる痛みを限定していなかったところ,本件訂正により「炎症を原因とする痛み」及び「手術を原因とする痛み」に限定していることからすると,本件発明3との関係においては,被告医薬品の効能・効果である神経障害性疼痛及び線維筋痛症に伴う疼痛を意図的に除外したと認めるのが相当である。
したがって,被告医薬品は均等の第5要件も満たさない。
(ウ)以上によれば,被告医薬品は,本件発明3の特許請求の範囲に記載された構成と均等なものとは認められない。
イ 被告医薬品が本件発明4の構成と均等なものであるかについて
前記アと同様に,いかなる痛みに対して鎮痛効果を有するかは,本件発明4の本質的部分というべきであり,被告医薬品は均等の第1要件を満たさず,また,本件発明4との関係においては,被告医薬品の効能・効果である神経障害性疼痛及び線維筋痛症に伴う疼痛が意図的に除外されているから,均等の第5要件も満たさない。
したがって,被告医薬品は,本件発明4の特許請求の範囲に記載された構成と均等なものとは認められない。
(3)小括
以上によれば,被告医薬品は,本件発明3及び4の各技術的範囲に属するとは認められないから,その余の点について判断するまでもなく,被告医薬品が本件特許権を侵害するとは認められない。
第5 結論
たがって,原告の請求はいずれも理由がないからこれを棄却することとして,主文のとおり判決する。
・・・
2 本件発明1及び2について
(1)争点1-1(実施可能要件違反の成否)について
ア 実施可能要件違反の判断基準について
いわゆる医薬用途発明においては,一般に,当業者にとって,物質名,化学構造等が示されることのみによっては,当該用途の有用性及びそのための当該医薬の有効量を予測することは困難であり,当該発明に係る医薬を当該用途に使用することができないから,そのような発明において実施可能要件を満たすためには,明細書の発明の詳細な説明に,薬理データの記載又はこれと同視し得る程度の記載をすることなどにより,当該用途の有用性及びそのための当該医薬の有効量を裏付ける記載を要するものと解するのが相当である。
本件発明1及び2の特許請求の範囲においては,本件化合物が「痛みの処置における」(構成要件1B)「鎮痛剤」(構成要件1C)及び「鎮痛剤」(構成要件2C)として作用することが記載されているところ,いずれも本件化合物の鎮痛効果が認められる痛みは特定されていない。しかし,本件明細書には,本件化合物について,「痛みの処置とくに慢性の疼痛性障害の処置における使用方法である。このような障害にはそれらに限定されるものではないが炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群が包含される。」(前記1(1)イ)と記載されていることに照らすと,本件発明1及び2は,本件化合物が少なくとも上記各痛みに対して鎮痛効果を有することを内容とするものと解される。
したがって,本件発明1及び2について実施可能要件を満たすというためには,本件明細書の発明の詳細な説明に,薬理データの記載又はこれと同視し得る程度の記載をすることなどにより,上記各痛みに対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載が必要であるというべきである。
イ 痛みの分類及び機序について
(ア)痛みの分類及び機序について,証拠(甲15の1,甲26,39,41,42,46,55,59,77ないし84,86,88,乙3ないし9)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)aないしgの文献の記載によれば,痛みは,その機序により大きく分けると,①炎症や組織損傷による侵害レセプターへの刺激により生じる侵害受容性疼痛,②末梢神経又は中枢神経が圧迫されたり,絞扼されたり,遮断されたりすることにより生じる神経障害性疼痛,③直接末梢からの侵害刺激がないにもかかわらず存在し,心因性のもので,特発性疼痛とも呼ばれる心因性疼痛の3つに分類することがすることができること,線維筋痛症は,上記③の心因性疼痛に分類されること,上記のとおりに分類された痛みの中にも様々なものがあり,それぞれの痛みについて機序や症状,治療方法が存在することが,本件出願当時,技術常識であったと認めるのが相当である。
(ウ)これに対して,原告は,痛覚過敏及び接触異痛は,通常の痛みとは異なり,末梢性感作や中枢性感作による神経の機能異常で生じる痛みであると主張し,その根拠として,本件出願当時に前記(ア)hないしlのとおりの文献が存在したことを指摘する。
しかし,前記(ア)h,i,k及びlの各文献は,マスタードオイル,カプサイシン及び切開による侵害刺激を与える実験の結果に基づくものであるから,これらの実験により,痛覚過敏及び接触異痛が,その原因にかかわらず,末梢性感作や中枢性感作による神経の機能異常により生じると,直ちにいうことはできない。
また,前記(ア)jの文献では,「NメチルDアスパラギン酸(NMDA)受容体の過剰活性は,神経障害性疼痛の発生における要因の1つである可能性がある。」,「動物の神経障害性疼痛モデルにおいて示唆されるように…,痛覚過敏は NMDA 受容体によって介在される「ワインドアップ現象」の提示である可能性がある。」などと記載されているところ,これらの記載は,NMDA受容体の過剰活性が神経障害性疼痛の要因となること,あるいは痛覚過敏がNMDA受容体によって介在されるワインドアップ現象(神経細胞の感作)によるものであることの可能性を指摘したにすぎず,これをもって,上記文献の記載内容が本件出願当時の技術常識であったということはできない。
そして,他に,本件出願当時,痛覚過敏及び接触異痛がその原因にかかわらず末梢性感作や中枢性感作による神経の機能異常で生じる痛みであることが技術常識であったと認めるに足りる的確な証拠はない。
したがって,原告の上記主張は採用することができない。
(エ)原告は,神経障害性疼痛は神経系の一次的な損傷あるいはその機能異常が原因となって生じた疼痛であり,線維筋痛症は痛覚過敏や接触異痛を伴う慢性疼痛症候群であると定義されるところ,神経障害性疼痛及び線維筋痛症に伴う痛覚過敏や接触異痛はいずれも神経細胞の感作により生じるものであると主張し,その根拠として,本件出願当時に前記(ア)mないしrのとおりの文献が存在したことを指摘する。
しかし,前記(ア)mの文献においては,線維筋痛症を痛覚過敏を伴う慢性疼痛症候群と定義する例があることが紹介されているものの,それは線維筋痛症の具体的な原因について言及するものではないし,痛覚過自体,前記(ウ)のとおり,その原因にかかわらず神経細胞の感作により生じるものであることが本件出願当時に技術常識であったとは認められない。また,上記文献は,線維筋痛症に「中枢性感作があること,および圧痛点が二次痛覚過敏を示すことも示唆される。」と記載するにとどまっており,上記文献の記載内容が本件出願当時の技術常識であったとは認め難い。
前記(ア)nの文献は,・・・。
そして,他に,本件出願当時,神経障害性疼痛及び線維筋痛症に伴う痛覚過敏及び接触異痛が神経細胞の感作により生じるものであったことが技術常識であったことを認めるに足りる的確な証拠はない。
したがって,原告の上記主張は採用することができない。
(オ)原告は,痛覚過敏及び接触異痛がその原因にかかわらず末梢や中枢の神経細胞の感作により生じることや,神経障害性疼痛及び線維筋痛症に伴う痛覚過敏や接触異痛がいずれも神経細胞の感作により生じることについて,専門家の意見書(甲67,68,124,125)を提出する。
しかし,上記の各意見書は,いずれも本件出願後に作成されたものであり,前記(ウ)及び(エ)のとおり,それらの記載内容を裏付け得る本件出願当時の技術常識に関する文献が存在するとは認められないから,いずれも採用することができない。
ウ ホルマリン試験について
(ア)本件明細書には,本件化合物に係るホルマリン試験の結果が記載されているところ,ホルマリン試験について,証拠(甲27,43,45ないし51,64)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)の各文献の記載によれば,本件出願当時,ホルマリンを皮下注射することにより二相の侵害応答が引き起こされ,そのうち後期相は炎症を反映した持続する疼痛であるところ,ホルマリン試験はこれら二相の侵害応答に対する薬剤の鎮痛効果を確かめる動物モデル試験であり,NSAIDは後期相において鎮痛効果を生じることが,技術常識であったと認められる。
そして,前記イ(イ)のとおりに痛みが分類されることや,NSAIDが一般的に侵害受容性疼痛に対して有効であると考えられており,神経障害性疼痛や線維筋痛症に対して有効であるとは考えられていなかったこと(甲123)を併せ考えると,ホルマリン試験の後期相は,侵害受容性疼痛に対する薬剤の鎮痛効果を確認するための試験と認めるのが相当である。
本件明細書には,「CI-1008」((S)-3-(アミノメチル)-5-メチルヘキサン酸であり(甲2),構成要件3Aを充足する本件化合物の一種である。)及び「3-アミノメチル-5-メチル-ヘキサン酸」(構成要件3A)がホルマリン試験の後期相において有効であったと記載されていること(前記1(1)エ)からすると,本件出願当時,本件明細書のホルマリン試験の結果に接した当業者は,本件化合物について,侵害受容性疼痛としての持続する疼痛に対して有効であると理解し,その他の痛みに対して有効であると理解することはなかったというべきである。
・・・
エ カラゲニン試験について
(ア)本件明細書には,本件化合物に係るカラゲニン試験の結果が記載されているところ,カラゲニン試験について,証拠(甲44,56,57,146)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)の各文献の記載によれば,本件出願当時,カラゲニン試験とは,カラゲニンにより炎症を誘発し,痛覚過敏の状態を引き起こして,これに対する薬剤の効果を確かめる試験であることが,技術常識であったと認められる。
そして,本件明細書には,本件化合物の一種である「CI-1008」(前記ウ(イ))がカラゲニン試験において有効であったことが記載されており,さらに,「これらのデータはギャバペンチンおよび CI-1008 が炎症性疼痛の処置に有効であることを示す。」(前記1(1)オ)との記載がある。
以上によれば,本件出願当時,本件明細書のカラゲニン試験の結果に接した当業者は,本件化合物について,侵害受容性疼痛としての痛覚過敏に対して有効であると理解し,その他の痛みに対して有効であると理解することはなかったというべきである。
・・・
オ 術後疼痛試験について
(ア)本件明細書には,本件化合物に係る術後疼痛試験の結果が記載されているところ,術後疼痛試験について,証拠(甲15の1,甲58)によれば,本件出願当時,以下の文献が存在したことが認められる。
・・・
(イ)前記(ア)の各文献の記載によれば,本件出願当時,術後疼痛試験は,ラットの皮膚,筋膜及び足蹠の足底側面の筋肉を切開することにより,痛覚過敏を引き起こし,これに対する薬剤の効果を確かめる試験であることが,技術常識であったと認められる。
そして,本件明細書には,「S-(+)-3-イソブチルギャバ」(構成要件3Aを充足する本件化合物の一種である(甲9)。)が術後疼痛試験において有効であったことが記載されており,さらに,「ラット足蹠筋肉の切開は熱痛覚過敏および接触異痛を生じた。いずれの侵害受容反応も手術後1時間以内にピークに達し,3日間維持された。実験期間中,動物はすべて良好な健康状態を維持した。」(前記1(1)キ(キ)),「ここに掲げた結果はラット足蹠筋肉の切開は少なくとも3時間続く熱痛覚過敏および接触異痛を誘発することを示している。本試験の主要な所見は,ギャバペンチンおよびS-(+)-3-イソブチルギャバがいずれの侵害受容反応の遮断に対しても等しく有効なことである。」(同(コ))との記載がある。
以上によれば,本件出願当時,本件明細書の術後疼痛試験の結果に接した当業者は,本件化合物について,侵害受容性疼痛としての熱痛覚過敏及び接触異痛に対して有効であると理解し,その他の痛みに対して有効であると理解することはなかったというべきである。
・・・
カ その他の原告の主張について
・・・
キ 小括
以上によれば,本件明細書の発明の詳細な説明においては,ホルマリン試験,カラゲニン試験及び術後疼痛試験の各薬理データの記載により,本件化合物が侵害受容性疼痛に分類される痛みに対して鎮痛効果があること及びそのための当該医薬の有効量が裏付けられているものの,本件発明1及び2がその内容とする「痛み」,すなわち,少なくとも「炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群」(前記1(1)イ)の
(2)争点1-2(サポート要件違反の成否)について
ア 特許請求の範囲の記載が明細書のサポート要件(法36条6項1号)に適合するか否かは,特許請求の範囲の記載と発明の詳細な説明の記載とを対比し,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か,また,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきものである。
イ 本件発明1及び2の特許請求の範囲において,本件化合物が「痛みの処置における」(構成要件1B)「鎮痛剤」(構成要件1C)又は「鎮痛剤」(構成要件2C)として作用することが記載されているところ,前記(1)アのとおり,本件明細書の記載に照らせば,上記各構成要件の記載は,本件化合物が少なくとも「炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群」の各痛みに対して鎮痛効果を有することを規定したものと解される。
そして,本件明細書の記載(前記1(1)ウ)によれば,本件発明1及び2は,少なくとも上記各痛みに対して,市場にある鎮痛剤,例えば,麻薬性鎮痛剤やNSAIDでは不十分な効果しか得られず,また,これらの鎮痛剤には副作用があるため,不完全な処置しか行われていなかったことから,上記各痛みに対する鎮痛効果が高く,副作用の少ない鎮痛剤を提供することを課題とし,この課題を解決しようとしたものであると認められる。
しかし,前記(1)キのとおり,本件明細書の発明の詳細な説明には,本件化合物について,上記各痛みのうち,侵害受容性疼痛に分類される痛みに対して鎮痛効果があることの記載はあるものの,その余の痛みに対して鎮痛効果があることについての記載があるとは認められない。
したがって,本件明細書の発明の詳細な説明の記載は,当業者が,本件発明1及び2の上記課題の解決,すなわち少なくとも上記各痛みの全てに対して鎮痛効果を有することを認識できる範囲のものとはいえず,また,当業者が本件出願当時の技術常識に照らして上記各痛みに対して鎮痛効果を有することを認識できる範囲のものともいえないから,本件発明1及び2は,サポート要件に違反する。
ウ これに対して,原告は,サポート要件を充足するといえるためには,明細書に接した当業者が技術常識も踏まえて課題が解決できるであろうとの合理的期待が得られれば足り,明細書に基づき追試や分析をすることによって更なる技術の発展に資することができれば足りると主張する。
しかし,明細書は,発明の技術内容を一般に開示するとともに,特許権として成立した後にその効力の及ぶ範囲(特許発明の技術的範囲)を明らかにするという役割を有するものであるから,サポート要件に適合するというためには,前記アのとおり,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものである必要があるというべきである。
そして,前記イのとおり,本件明細書に接した当業者は,本件出願当時の技術常識を踏まえても,本件発明1及び2で鎮痛効果を有するとされる各痛みに対して鎮痛効果を生じると認識することができたとはいえない。
したがって,原告の上記主張は採用することができない。
(3)争点1-3(本件訂正が訂正要件を満たすか)について
ア 請求項2に係る本件訂正について
請求項2に係る本件訂正のうち,「鎮痛剤」(構成要件2C)を「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤」(構成要件2B’及び2C)と訂正する点について,形式上は,特許請求の範囲を減縮するものといえる。
しかし,前記(1)キのとおり,本件明細書の発明の詳細な説明には,本件化合物について,侵害受容性疼痛に対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載があるものの,その他の痛みに対して鎮痛効果があることなどを裏付ける記載があるとはいえない。そして,前記(1)イ(イ)によれば,「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」とは,侵害受容性疼痛ではなく,神経障害性疼痛又は心因性疼痛に分類されるものである。
したがって,上記訂正は,神経障害性疼痛又は心因性疼痛の処置における鎮痛剤という新規事項を追加するものであって,本件明細書に記載した事項の範囲内においてされたものではないので,訂正要件を満たすとは認められない(法134条の2第9項,126条5項)。
イ 請求項1に係る本件訂正について
本件訂正前の請求項2は請求項1を引用しており,これらは一群の請求項を構成する。そして,請求項2に係る本件訂正は,当該請求項についての訂正が認められるときは請求項1とは別の訂正単位として扱われることを求めるものである。しかし,前記アのとおり,請求項2に係る本件訂正は認められないから,請求項1と請求項2は依然として一群の請求項を構成していることになり,請求項1に係る本件訂正も認められない(法134条の2第3項)。
(4)小括
以上によれば,その余の点を判断するまでもなく,本件発明1及び2については,実施可能要件違反及びサポート要件違反が認められるから,無効の抗弁は理由があり,請求項1及び請求項2に係る本件訂正は訂正要件に違反するものであるから,訂正の再抗弁は理由がない。
したがって,延長登録により存続期間が延長された本件特許権の効力が被告医薬品に及ぶか否かにかかわらず,原告の被告に対する本件発明1及び2に基づく被告医薬品の製造,販売及び販売の申出の差止請求並びに被告医薬品の廃棄請求は,いずれも理由がない。
3 本件発明3及び4について
(1)争点2-1(文言侵害の成否)について
ア 被告医薬品の構成要件3Bの充足性について
(ア)本件発明3の特許請求の範囲及び本件明細書の各記載
a 本件発明3の特許請求の範囲には,「炎症を原因とする痛み,又は手術を原因とする痛みの処置における」(構成要件3B)「鎮痛剤」(構成要件3C)との記載がある。
b 本件明細書には,「発明の背景」として,「本発明は,痛みの治療において鎮痛/抗痛覚過敏作用を発揮する化合物としてのグルタミン酸およびγ-アミノ酪酸(GABA)の類縁体の使用である。」(前記1(1)ア)との記載があり,「発明の概要」として,「本発明は,以下の式Ⅰの化合物の,痛みの処置とくに慢性の疼痛性障害の処置における使用方法である。このような障害にはそれらに限定されるものではないが炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性疱疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群が包含される。」(前記1(1)イ)との記載があり,「発明の詳述」として,「本発明は,上記式Ⅰの化合物の上に掲げた痛みの処置における鎮痛剤としての使用方法である。痛みにはとくに炎症性疼痛,神経障害の痛み,癌の痛み,術後疼痛,および原因不明の痛みである特発性疼痛たとえば幻想肢痛が包含される。」(前記1(1)ウ)との記載がある。
また,本件明細書には,構成要件3Aを充足する本件化合物の一種である「CI-1008」及び「S-(+)-3-イソブチルギャバ」(前記2(1)ウ(イ),オ(イ))について,ホルマリン試験,カラゲニン試験及び術後疼痛試験を実施し,鎮痛効果があったことが記載されている(前記1(1)エ,オ及びキ)。
(イ)本件訂正の経緯
証拠(甲3,4,18,21,乙1,2)によれば,本件訂正の経緯について,以下の事実を認めることができる。
a 特許庁は,本件無効審判事件において,平成31年2月28日付けで,① 本件明細書の発明の詳細な説明の記載は,ホルマリン試験,カラゲニン試験及び術後疼痛試験の結果に基づき,本件化合物が本件訂正前発明4記載の各痛みを初めとする種々の種類の痛みの治療に有効であることを当業者に認識させようとするものであること,② 本件明細書のホルマリン試験及びカラゲニン試験の結果の記載を見た当業者であれば,本件化合物が本件訂正前発明4記載の「炎症性疼痛」の処置における鎮痛効果を有すると認識することができ,術後疼痛試験の結果の記載を見た当業者であれば,本件化合物が本件訂正前発明4記載の「術後疼痛」の処置における鎮痛効果を有すると認識できること,③ 痛みには本件訂正前発明4記載の各痛みを含む種々のものがあり,その原因や病態生理も様々であることは,本件出願当時の技術常識であり,鎮痛剤であればあらゆる種類の痛みに有効であるというわけではないことも,本件出願当時の技術常識であったこと,④ 当業者は,本件明細書のホルマリン試験,カラゲニン試験及び術後疼痛試験の結果の記載に接しても,本件発明1及び2並びに本件訂正前発明3及び4に係る鎮痛剤が「炎症性疼痛」及び「術後疼痛」以外の本件訂正前発明4記載の各痛みの処置における鎮痛効果を有することを認識することができないから,本件明細書の発明の詳細な説明の記載は,本件発明1及び2並びに本件訂正前発明3及び4を実施することができる程度に明確かつ十分に記載されたものとはいえないこと,⑤ 本件明細書の発明の詳細な説明に接した当業者が,本件発明1及び2並びに本件訂正前発明3及び4により,本件訂正前発明4記載の各痛みを含む痛みの処置をすることができる鎮痛剤を提供するという課題を解決できると認識できるとはいえないから,本件訂正前発明1ないし4は,本件明細書の発明の詳細な説明に記載されたものではないことを理由として,本件特許は平成14年法律第24号による改正前の法36条4項,法36条6項1号に規定する各要件を満たさず,法123条1項4号により無効とすべきものである旨の本件審決予告をした(甲21,乙2)。
b 原告は,前記aの本件審決予告を受け,令和元年7月1日付けで,本件発明1及び2並びに本件訂正前発明3及び4を前記前提事実(3)イのとおりに訂正する本件訂正をした(甲3,4)。
さらに,原告は,同年8月7日付けの手続補正書により本件訂正に係る訂正請求書を補正したところ,補正後の訂正請求書の訂正の理由では,① 請求項3に係る本件訂正について,「炎症を原因とする痛み,又は手術を原因とする痛みの処置における」との記載により,鎮痛剤の処置対象となる痛みを限定するものであるところ,本件明細書に記載されたカラゲニン試験では,カラゲニンを用いて炎症を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用い,また,術後疼痛試験では,手術を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用いていることなどからすると,本件明細書等に記載された事項の範囲内のものであること,② 請求項4に係る本件訂正について,訂正前の請求項4においては炎症性疼痛から線維筋痛症までの13項目の痛みが選択的に記載されていたものを,「炎症性疼痛」及び「術後疼痛」のみを残し,その他の選択肢を削除するとともに,「炎症性疼痛」については,これによって生じる痛みのうち鎮痛剤の処置対象とする痛みを,「による痛覚過敏の」との記載により痛覚過敏に特定し,「術後疼痛」については,これによって生じる痛みのうち鎮痛剤の処置対象とする痛みを,「による痛覚過敏若しくは接触異痛の」との記載により痛覚過敏又は接触異痛に特定することによって限定するものであるところ,本件明細書に記載されたホルマリン試験では,ホルマリンを用いた侵害刺激の後期相(痛覚過敏及び接触異痛)の処置に本件化合物を用い,カラゲニン試験では,カラゲニンを用いて炎症を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用い,また,術後疼痛試験では,手術を原因とする痛みを引き起こし,この痛みの処置に本件化合物を用いていることなどからすると,本件明細書等に記載された事項の範囲内のものであることが記載されていた(甲4)。
c また,原告は,本件訂正とともに,令和元年7月1日付けで,① 本件訂正発明1及び2について,本件明細書に記載されたホルマリン試験,カラゲニン試験及び術後疼痛試験により,これらの鎮痛剤が痛覚過敏又は接触異痛の痛みに対して効果を奏することが明確に確認されており,当業者は,痛覚過敏や接触異痛等の原因となる神経の機能異常が原因の疼痛である神経障害性疼痛や痛覚過敏を伴う疼痛である線維筋痛症に対しても効果を奏すると理解するので,実施可能要件及びサポート要件を満たすこと,② 本件発明3及び4について,本件審決予告において実施可能要件及びサポート要件を満たすと判断された「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定するものであるから,実施可能要件及びサポート要件を満たすことを記載したことを記載した上申書を提出した(甲18,乙1)。
(ウ)構成要件3Bの充足性
a 前記(ア)の本件発明3に係る特許請求の範囲及び本件明細書の記載を総合すると,構成要件3Bの「炎症を原因とする痛み」及び「手術を原因とする痛み」とは,それぞれ本件明細書における「炎症性疼痛」及び「術後疼痛」を意味するものと理解できる。
そして,前記(ア)bのとおり,本件明細書には,構成要件3Aを充足する「CI-1008」及び「S-(+)-3-イソブチルギャバ」について,ホルマリン試験,カラゲニン試験及び術後疼痛試験において鎮痛効果があったことが記載されているところ,前記2(1)ウないしオのとおり,ホルマリン試験,カラゲニン試験及び術後疼痛試験は侵害受容性疼痛としての痛覚過敏,接触異痛等に対する鎮痛効果を検証するための試験であることが本件出願当時の技術常識であったから,本件明細書において動物モデル試験により本件化合物の鎮痛効果が検証されたのは,侵害受容性疼痛のみであったと理解できる。
さらに,前記(イ)のとおり,本件審決予告において,痛みには本件訂正前発明4記載の各痛みを含む種々のものがあり,鎮痛剤であればあらゆる種類の痛みに有効であるというわけではないところ,本件明細書からは,「炎症性疼痛」及び「術後疼痛」以外の本件訂正前発明4記載の各痛みに対して鎮痛効果を有することを認識することはできな いと指摘されたことを受けて,原告は,本件訂正を行い,鎮痛剤の処置対象となる痛みを,本件審決予告において実施可能要件及びサポート要件を満たすと判断された「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定したと説明したものである。
以上の本件発明3に係る特許請求の範囲及び本件明細書の記載の解釈並びに本件訂正の経緯等によれば,構成要件3Bの「炎症を原因とする痛み」及び「手術を原因とする痛み」とは,侵害受容性疼痛である炎症性疼痛及び術後疼痛を意味し,これら以外の痛みを含むものではないと解するのが相当である。
b 前記前提事実(5)アのとおり,被告医薬品は,効能・効果を神経障害性疼痛及び線維筋痛症に伴う疼痛とする疼痛治療剤であり,「炎症を原因とする痛み」及び「手術を原因とする痛み」の鎮痛剤であるとは認められないから,構成要件3Bを充足するとは認められない。
(エ)原告の主張について
a 原告は,本件明細書のカラゲニン試験や術後疼痛試験により,神経細胞の感作により生じる神経障害性疼痛や線維筋痛症に伴う疼痛等の慢性疼痛に共通する痛覚過敏や接触異痛に対する効果が確認されたので,本件発明3の技術的範囲には,神経の病変や疾患,損傷が関与するか否かにかかわらず,炎症や手術によって生じる痛覚過敏や接触異痛の全てが含まれると主張する。
しかし,前記2(1)イ(エ)のとおり,本件出願当時,痛覚過敏及び接触異痛が,その原因にかかわらず,神経細胞の感作により生じる痛みであることが技術常識であったとは認められない。
また,前記2(1)エ及びオのとおり,本件明細書に記載されたカラゲニン試験及び術後疼痛試験により,本件化合物について,侵害受容性疼痛としての痛覚過敏や接触異痛に対する鎮痛効果が確かめられたものであって,痛みの原因にかかわらず痛覚過敏や接触異痛に対する鎮したがって,原告の上記主張は採用することができない。
b 原告は,神経障害性疼痛や線維筋痛症に伴う疼痛は侵害受容性疼痛との混合性疼痛とされるところ,被告医薬品はこのような混合性疼痛を生じた患者の痛みの処置に用いられるから,本件発明3の技術的範囲が侵害受容性疼痛に限られるか否かにかかわらず,また,侵害受容性疼痛の定義とは無関係に,被告医薬品の鎮痛の対象は「炎症を原因とする痛み,又は手術を原因とする痛み」(構成要件3B)を充足すると主張する。
しかし,前記2(1)カ(イ)のとおり,本件出願当時,痛みは侵害受容性疼痛,神経障害性疼痛及び心因性疼痛に大別されたところ,侵害受容性疼痛である炎症性疼痛や術後疼痛が生じると必ず神経障害性疼痛や心因性疼痛である線維筋痛症に伴う痛みを生じるということが技術常識であったとは認められず,これらの痛みを併発することがあったとしても,当業者が,これらを一つの混合性疼痛として理解し,侵害受容性疼痛に対して有効である鎮痛剤が神経障害性疼痛又は心因性疼痛に対しても有効であり,神経障害性疼痛又は心因性疼痛に対して有効である鎮痛剤が侵害受容性疼痛に対しても有効であると認識していたとは認められない。
また,前記(ウ)のとおり,「炎症を原因とする痛み」及び「手術を原因とする痛み」とは侵害受容性疼痛である炎症性疼痛及び術後疼痛を意味し,本件発明3に係る特許請求の範囲及び本件明細書の各記載を見ても,これらが炎症又は手術を原因として生じた神経障害性疼痛や線維筋痛症に伴う疼痛をも含むと理解することはできず,このような解釈が本件出願当時の技術常識であったことを認めるに足りる証拠もない。
したがって,原告の上記主張は採用することができない。
c 原告は,① 本件訂正の前後を問わず,カラゲニン試験や術後疼痛試験により神経障害性疼痛や線維筋痛症に伴う疼痛に対する本件化合物の効果を確認することができると一貫して主張してきたものであり,② 本件審決予告は,神経障害性疼痛や線維筋痛症に伴う疼痛のうちカラゲニン試験や術後疼痛試験の痛みに含まれる部分についてまで本件化合物の効果を確認することができないとまでは判断していないと主張する。
しかし,上記①について,証拠(甲18,19)によれば,原告は,本件訂正後も,カラゲニン試験や術後疼痛試験により,本件化合物が神経障害性疼痛や線維筋痛症に伴う疼痛に対して鎮痛効果を有することを確認することができるなどと主張していることが認められるが,前記前提事実(3)のとおり,請求項1及び2に係る本件訂正においては,請求項3及び4に係る本件訂正とは異なり,鎮痛の対象を「痛覚過敏又は接触異痛の痛み」及び「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」としていたものである。そして,前記(イ)のとおり,本件審決予告は,本件明細書に記載されたカラゲニン試験及び術後疼痛試験の結果を見た当業者は,炎症性疼痛及び術後疼痛の処置において鎮痛効果を有すると認識し,これら以外の痛みの処置において鎮痛効果を有すると認識することはできないから,本件特許には実施可能要件違反及びサポート要件違反が認められると指摘し,これを受けて,原告は,請求項3及び4に係る本件訂正を行い,これによって請求項3及び4の「痛み」を本件審決予告において実施可能要件及びサポート要件を満たすと判断された「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定するものであると説明した。そうすると,請求項3及び4との関係においては,原告は,本件化合物の鎮痛の対象を「炎症を原因とする痛み(炎症性疼痛)」及び「手術を原因とする痛み(術後疼痛)」に限定する意図であったことは明らかである。
また,上記②については,本件審決予告における上記の指摘に照らし,本件審決予告が神経障害性疼痛や線維筋痛症に伴う疼痛のうちカラゲニン試験及び術後疼痛試験により鎮痛効果を確認することができる部分が存在することを前提としていないことは明らかである。
したがって,原告の上記各主張はいずれも採用することができない。
イ 被告医薬品の構成要件4Bの充足性について
本件発明4の特許請求の範囲には,「炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における」(構成要件4B)「鎮痛剤」(構成要件4C)との記載がある。
そして,前記ア(ウ)によれば,構成要件4Bの「炎症性疼痛」及び「術後疼痛」とは,構成要件3Bの「炎症を原因とする痛み」及び「手術を原因とする痛み」と同様に,侵害受容性疼痛である炎症性疼痛及び術後疼痛を意味し,本件訂正前発明4記載の「神経障害による痛み」及び「線維筋痛症」は含まないと解するのが相当である。
そうすると,前記前提事実(5)アのとおり,被告医薬品は,効能・効果を神経障害性疼痛及び線維筋痛症に伴う疼痛とする疼痛治療剤であり,「炎症性疼痛」及び「術後疼痛」の鎮痛剤であるとは認められないから,構成要件4Bを充足するとは認められない。
(2)争点2-2(均等侵害の成否)について
ア 被告医薬品が本件発明3の構成と均等なものであるかについて
(ア)原告は,本件発明3は,慢性疼痛に対する画期的処方薬として,抗てんかん作用を有するGABA類縁体を痛みの処置に用いることを見いだしたものであり,その本質的部分は本件化合物を慢性疼痛の処置に用いる点にあるから,対象となる痛みが侵害受容性疼痛か,神経障害性疼痛や線維筋痛症かは本質的部分ではなく,効能・効果を神経障害性疼痛や線維筋痛症に伴う疼痛とし,慢性疼痛の処置に用いる鎮痛剤である被告医薬品は,均等侵害の第1要件を満たすと主張する。
しかし,前記1(1)アのとおり,本件特許に係る発明は,てんかん,ハンチントン舞踏病等の中枢性神経系疾患に対する抗発作療法等に有用な薬物である本件化合物が,痛みの治療における鎮痛作用及び抗痛覚過敏作用を有し,反復使用により耐性を生じず,モルヒネと交叉耐性がないことに着目した医薬用途発明であるところ,前記2(1)イのとおり,本件出願当時,痛みには種々のものがあり,その原因や機序も様々であることが技術常識であった。
そうすると,いかなる痛みに対して鎮痛効果を有するかは,本件発明3において本質的部分というべきであり,その鎮痛効果の対象を異にする被告医薬品は,本件発明3の本質的部分を備えているものと認めることはできない。したがって,本件発明3に係る特許請求の範囲に記載された構成中の被告医薬品と異なる部分が本件発明3の本質的部分でないということはできないから,被告医薬品は均等の第1要件を満たさない。
(イ)また,前記(1)アによれば,原告は,本件訂正前発明3においては鎮痛の対象となる痛みを限定していなかったところ,本件訂正により「炎症を原因とする痛み」及び「手術を原因とする痛み」に限定していることからすると,本件発明3との関係においては,被告医薬品の効能・効果である神経障害性疼痛及び線維筋痛症に伴う疼痛を意図的に除外したと認めるのが相当である。
したがって,被告医薬品は均等の第5要件も満たさない。
(ウ)以上によれば,被告医薬品は,本件発明3の特許請求の範囲に記載された構成と均等なものとは認められない。
イ 被告医薬品が本件発明4の構成と均等なものであるかについて
前記アと同様に,いかなる痛みに対して鎮痛効果を有するかは,本件発明4の本質的部分というべきであり,被告医薬品は均等の第1要件を満たさず,また,本件発明4との関係においては,被告医薬品の効能・効果である神経障害性疼痛及び線維筋痛症に伴う疼痛が意図的に除外されているから,均等の第5要件も満たさない。
したがって,被告医薬品は,本件発明4の特許請求の範囲に記載された構成と均等なものとは認められない。
(3)小括
以上によれば,被告医薬品は,本件発明3及び4の各技術的範囲に属するとは認められないから,その余の点について判断するまでもなく,被告医薬品が本件特許権を侵害するとは認められない。
第5 結論
たがって,原告の請求はいずれも理由がないからこれを棄却することとして,主文のとおり判決する。
コメント