2024年5月中旬~6月の間に公開された、医薬分野の特許の無効審判、異議申立、判定請求を調べました。件数は以下の通りでした。
○存続期間延長登録の無効審判:2
○異議申立:3
○判定請求:0
また、同期間に公開された審決等を調べました。件数は以下の通りでした。
○無効審判の審決:1
○存続期間延長登録の無効審判の審決:0
○異議の決定:0
○判定:0
各事件の概要を下に記載しています。
補足説明:対象は、医薬品、創薬技術、診断技術に関連するものを含み、シリンジ、医薬包装、医薬関連装置は含みません。一覧中、「関連医薬品」は簡易調査して記載したものであり、特許庁が特定しているものではありません。「審判請求人」は現時点で未公開の場合は、後日公開された後に更新予定です。
無効審判
No.1
【関連医薬品】
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800070(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
5419866(2031/04/27)
【発明の名称】
新たな医薬組成物
【請求項1】
3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メチル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン)を含む医薬錠剤であって、配位金属を含まず、および還元糖を含まない1つまたは複数の希釈剤を使用する湿式造粒プロセスによって製造される医薬錠剤。
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800070(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
5419866(2031/04/27)
【発明の名称】
新たな医薬組成物
【請求項1】
3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メチル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン)を含む医薬錠剤であって、配位金属を含まず、および還元糖を含まない1つまたは複数の希釈剤を使用する湿式造粒プロセスによって製造される医薬錠剤。
No.2
【関連医薬品】
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800071(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
5735078(2029/12/01)
【発明の名称】
新たな医薬組成物
【請求項1】
a)3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メチル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン)の化合物を含む医薬錠剤であって、ここで
b)化合物の粒子の90%が10ミクロンより大きいが、90ミクロンより小さい粒径を有し;
c)結晶セルロース、粉末セルロース、アルファ化デンプン、デンプン、ラクチトール、マンニトール、ソルビトールおよびマルトデキストリンからなる群より選択される一または複数の賦形剤を25重量%~89重量%にて含有し;
d)フィルムコーティングされ;
e)4重量%と等しいかまたはそれより多い量の崩壊剤を含有し;
f)8重量%までの量の結合剤を含有してもよく;
g)2重量%までの量の潤滑剤を含有してもよい、医薬錠剤であるが但し、
賦形剤に対して5重量%までの量の配位金属および/または還元糖を含有してもよい、医薬錠剤。
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800071(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
5735078(2029/12/01)
【発明の名称】
新たな医薬組成物
【請求項1】
a)3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メチル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン)の化合物を含む医薬錠剤であって、ここで
b)化合物の粒子の90%が10ミクロンより大きいが、90ミクロンより小さい粒径を有し;
c)結晶セルロース、粉末セルロース、アルファ化デンプン、デンプン、ラクチトール、マンニトール、ソルビトールおよびマルトデキストリンからなる群より選択される一または複数の賦形剤を25重量%~89重量%にて含有し;
d)フィルムコーティングされ;
e)4重量%と等しいかまたはそれより多い量の崩壊剤を含有し;
f)8重量%までの量の結合剤を含有してもよく;
g)2重量%までの量の潤滑剤を含有してもよい、医薬錠剤であるが但し、
賦形剤に対して5重量%までの量の配位金属および/または還元糖を含有してもよい、医薬錠剤。
No.3
【関連医薬品】
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800072(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
6144713(2027/11/06)
【発明の名称】
新たな医薬組成物
【請求項1】
a)2重量%~65重量%の3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メチル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン);
b)25重量%~89重量%の、結晶セルロース、粉末セルロース、アルファ化デンプン、デンプン、ラクチトール、マンニトール、ソルビトールおよびマルトデキストリンからなる群から選択される1以上の希釈剤;
c)4重量%~12重量%の崩壊剤;
d)8重量%までの結合剤:および
e)2重量%までの潤滑剤を含む医薬錠剤であって、
含有される希釈剤は、配位金属および還元糖を実質的に含まない医薬錠剤。
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800072(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
6144713(2027/11/06)
【発明の名称】
新たな医薬組成物
【請求項1】
a)2重量%~65重量%の3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メチル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン);
b)25重量%~89重量%の、結晶セルロース、粉末セルロース、アルファ化デンプン、デンプン、ラクチトール、マンニトール、ソルビトールおよびマルトデキストリンからなる群から選択される1以上の希釈剤;
c)4重量%~12重量%の崩壊剤;
d)8重量%までの結合剤:および
e)2重量%までの潤滑剤を含む医薬錠剤であって、
含有される希釈剤は、配位金属および還元糖を実質的に含まない医薬錠剤。
No.4
【関連医薬品】
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800073(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
6560289(2027/08/01)
【発明の名称】
新たな医薬組成物
【請求項1】
3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メ
チル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ
-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン)を含む薬物粒子を含む医薬錠剤であって、配位金属を実質的に含まず、当該薬物粒子の約90%が、10ミクロンより大きくが90ミクロンより小さい粒径を有する医薬錠剤。
レボレード錠 12.5mg(エルトロンボパグ オラミン)
*延長登録出願あり
【審判番号(請求日)】
2024-800073(2024/05/30)
【審判請求人/被請求人】
-/
ノバルティス アーゲー
【特許番号(満了日)】
6560289(2027/08/01)
【発明の名称】
新たな医薬組成物
【請求項1】
3’-[(2Z)-[1-(3,4-ジメチルフェニル)-1,5-ジヒドロ-3-メ
チル-5-オキソ-4H-ピラゾール-4-イリデン]ヒドラジノ]-2’-ヒドロキシ
-[1,1’-ビフェニル]-3-カルボン酸ビス-(モノエタノールアミン)を含む薬物粒子を含む医薬錠剤であって、配位金属を実質的に含まず、当該薬物粒子の約90%が、10ミクロンより大きくが90ミクロンより小さい粒径を有する医薬錠剤。
No.5
【関連医薬品】
トラゼンタ錠5mg(リナグリプチン)
トラディアンス配合錠AP、BP(エンパグリフロジン/リナグリプチン)
*用途限定との対応は未検討
【審判番号(請求日)】
2024-800075(2024/05/31)
【審判請求人/被請求人】
-/
ベーリンガー インゲルハイム インターナショナル ゲゼルシャ
【特許番号(満了日)】
7174020(2029/10/15)
【発明の名称】
経口又は非経口抗糖尿病薬による治療にもかかわらず不十分な血糖調節の患者の糖尿病の治療
【請求項1】
i)スルホニル尿素、又はii)メトホルミン及びスルホニル尿素を用いた治療にもかかわらず不十分な血糖調節の患者であって且つ腎臓障害を有する前記患者の、2型糖尿病及び糖尿病性合併症から選択される代謝性疾患の治療及び/又は予防のための、下記式(I)又はその医薬上許される塩であるDPP-4阻害剤を含む医薬組成物であって、
前記医薬組成物は、1日1回の経口投与用であり且つ5mgの前記DPP-4阻害剤を含むか、或いは、
前記医薬組成物は、1日2回の経口投与用であり且つ2.5mgの前記DPP-4阻害剤を含む、前記医薬組成物:
式 (I)
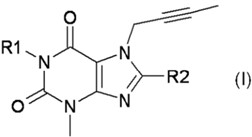
[式中、R1は(4-メチル-キナゾリン-2-イル)メチルを表し、かつR2は3-(R)-アミノ-ピペリジン-1-イルを表す]。
トラゼンタ錠5mg(リナグリプチン)
トラディアンス配合錠AP、BP(エンパグリフロジン/リナグリプチン)
*用途限定との対応は未検討
【審判番号(請求日)】
2024-800075(2024/05/31)
【審判請求人/被請求人】
-/
ベーリンガー インゲルハイム インターナショナル ゲゼルシャ
【特許番号(満了日)】
7174020(2029/10/15)
【発明の名称】
経口又は非経口抗糖尿病薬による治療にもかかわらず不十分な血糖調節の患者の糖尿病の治療
【請求項1】
i)スルホニル尿素、又はii)メトホルミン及びスルホニル尿素を用いた治療にもかかわらず不十分な血糖調節の患者であって且つ腎臓障害を有する前記患者の、2型糖尿病及び糖尿病性合併症から選択される代謝性疾患の治療及び/又は予防のための、下記式(I)又はその医薬上許される塩であるDPP-4阻害剤を含む医薬組成物であって、
前記医薬組成物は、1日1回の経口投与用であり且つ5mgの前記DPP-4阻害剤を含むか、或いは、
前記医薬組成物は、1日2回の経口投与用であり且つ2.5mgの前記DPP-4阻害剤を含む、前記医薬組成物:
式 (I)

[式中、R1は(4-メチル-キナゾリン-2-イル)メチルを表し、かつR2は3-(R)-アミノ-ピペリジン-1-イルを表す]。
No.6
【関連医薬品】
-
【審判番号(請求日)】
2024-800066(2024/05/15)
【審判請求人/被請求人】
上海信譜生物医薬科技有限公司/
トリリンク バイオテクノロジーズ エルエルシー
【特許番号(満了日)】
6814997(2036/09/20)
【発明の名称】
5’キャップ付RNAを合成するための組成物および方法
【請求項1】
以下の構造を含む開始キャップ付オリゴヌクレオチドプライマー:
【化1】
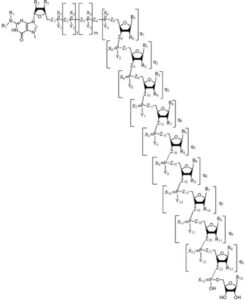
[式中、
B1からB10の各々は独立に、天然、修飾または非天然ヌクレオシド塩基であり、
mは、0または1であり、
lは、0または1であり、
q1は、1であり、q2からq9の各々は独立に、0または1であり、
R1は、Hまたはメチルであり、
R2およびR3は独立に、H、OH、アルキル、O-アルキル、ハロゲン、リンカーまたは検出可能なマーカーであり、
X1からX13の各々は独立に、OまたはSであり、
Y1からY12の各々は独立に、OH、SH、BH3、アリール、アルキル、O-アルキルまたはO-アリールであり、
Z1からZ22の各々は独立に、O、S、NH、CH2、C(ハロゲン)2またはCH(ハロゲン)であり、
R4からR12の各々は独立に、H、OH、OMeまたは検出可能なマーカーである。
ここで、
B1は、転写鋳型位置+1で核酸鋳型上のヌクレオシド塩基と完全に相補的であり、
B2からB9は、存在する場合には、位置+2以降の転写開始部位で核酸鋳型上のそれぞれのヌクレオシド塩基と完全に相補的であり、
B10、開始キャップ付オリゴヌクレオチドプライマーの最後のヌクレオシド塩基は、最後のハイブリダイズされる転写鋳型ヌクレオチドと完全に相補的である。]。
-
【審判番号(請求日)】
2024-800066(2024/05/15)
【審判請求人/被請求人】
上海信譜生物医薬科技有限公司/
トリリンク バイオテクノロジーズ エルエルシー
【特許番号(満了日)】
6814997(2036/09/20)
【発明の名称】
5’キャップ付RNAを合成するための組成物および方法
【請求項1】
以下の構造を含む開始キャップ付オリゴヌクレオチドプライマー:
【化1】

[式中、
B1からB10の各々は独立に、天然、修飾または非天然ヌクレオシド塩基であり、
mは、0または1であり、
lは、0または1であり、
q1は、1であり、q2からq9の各々は独立に、0または1であり、
R1は、Hまたはメチルであり、
R2およびR3は独立に、H、OH、アルキル、O-アルキル、ハロゲン、リンカーまたは検出可能なマーカーであり、
X1からX13の各々は独立に、OまたはSであり、
Y1からY12の各々は独立に、OH、SH、BH3、アリール、アルキル、O-アルキルまたはO-アリールであり、
Z1からZ22の各々は独立に、O、S、NH、CH2、C(ハロゲン)2またはCH(ハロゲン)であり、
R4からR12の各々は独立に、H、OH、OMeまたは検出可能なマーカーである。
ここで、
B1は、転写鋳型位置+1で核酸鋳型上のヌクレオシド塩基と完全に相補的であり、
B2からB9は、存在する場合には、位置+2以降の転写開始部位で核酸鋳型上のそれぞれのヌクレオシド塩基と完全に相補的であり、
B10、開始キャップ付オリゴヌクレオチドプライマーの最後のヌクレオシド塩基は、最後のハイブリダイズされる転写鋳型ヌクレオチドと完全に相補的である。]。
存続期間延長登録の無効審判
No.7
【関連医薬品】
アミティーザカプセル24μg(ルビプロストン)
【審判番号(請求日)】
2024-800068(2024/05/21)
【審判請求人/被請求人】
-/
スキャンポ・アーゲー
【特許番号(満了日)】
4332316(2025/10/13)
【発明の名称】
二環式化合物組成物およびその安定化方法
【請求項1】
下記一般式(I)
【化1】
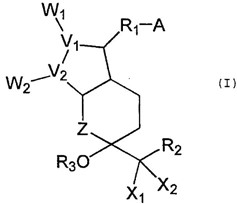
[式中、
Aは、-CH2OH、-COOHまたはそれらの塩、エステル、エーテルまたはアミド;
X1およびX2は、水素、低級アルキルまたはハロゲン;
V1およびV2は、炭素;
W1およびW2は、
【化2】
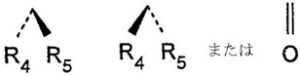
(R4及びR5は、水素またはヒドロキシ。ただし、R4およびR5が同時にヒドロキシとなることはない。);
Zは、炭素、酸素、イオウまたは窒素;
R1は、二価の飽和または不飽和、低~中級脂肪族炭化水素残基;
R2は、非置換またはハロゲン、オキソ、ヒドロキシ、低級アルキル、低級アルコキシ、低級アルカノイルオキシ、低級シクロアルキル、低級シクロアルキルオキシ、アリール、アリールオキシ、複素環基または複素環-オキシ基で置換された、飽和または不飽和、低~中級脂肪族炭化水素残基;
R3は、水素または低級アルキル]
で表される二環式化合物を1重量部、および
グリセリドを1~5,000,000重量部含有する新規組成物。
アミティーザカプセル24μg(ルビプロストン)
【審判番号(請求日)】
2024-800068(2024/05/21)
【審判請求人/被請求人】
-/
スキャンポ・アーゲー
【特許番号(満了日)】
4332316(2025/10/13)
【発明の名称】
二環式化合物組成物およびその安定化方法
【請求項1】
下記一般式(I)
【化1】

[式中、
Aは、-CH2OH、-COOHまたはそれらの塩、エステル、エーテルまたはアミド;
X1およびX2は、水素、低級アルキルまたはハロゲン;
V1およびV2は、炭素;
W1およびW2は、
【化2】

(R4及びR5は、水素またはヒドロキシ。ただし、R4およびR5が同時にヒドロキシとなることはない。);
Zは、炭素、酸素、イオウまたは窒素;
R1は、二価の飽和または不飽和、低~中級脂肪族炭化水素残基;
R2は、非置換またはハロゲン、オキソ、ヒドロキシ、低級アルキル、低級アルコキシ、低級アルカノイルオキシ、低級シクロアルキル、低級シクロアルキルオキシ、アリール、アリールオキシ、複素環基または複素環-オキシ基で置換された、飽和または不飽和、低~中級脂肪族炭化水素残基;
R3は、水素または低級アルキル]
で表される二環式化合物を1重量部、および
グリセリドを1~5,000,000重量部含有する新規組成物。
No.8
【関連医薬品】
アミティーザカプセル24μg(ルビプロストン)
【審判番号(請求日)】
2024-800069(2024/05/21)
【審判請求人/被請求人】
-/
スキャンポ・アーゲー
【特許番号(満了日)】
4684334(2026/09/04)
【発明の名称】
下剤組成物
【請求項1】
下記式で表される二環式化合物:
【化1】
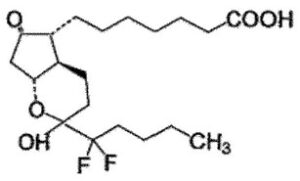
またはその医薬上許容しうる塩またはエステルを便通誘導のために有効な量を含む下剤組成物。
アミティーザカプセル24μg(ルビプロストン)
【審判番号(請求日)】
2024-800069(2024/05/21)
【審判請求人/被請求人】
-/
スキャンポ・アーゲー
【特許番号(満了日)】
4684334(2026/09/04)
【発明の名称】
下剤組成物
【請求項1】
下記式で表される二環式化合物:
【化1】

またはその医薬上許容しうる塩またはエステルを便通誘導のために有効な量を含む下剤組成物。
異議申立
No.9
【関連医薬品】
-
【異議事件番号(申立日)】
2024-700492(2024/05/24)
【異議申立人/特許権者】
-/
パラダイム バイオファーマシューティカルズ リミテッド
【特許番号(満了日)】
7391858(2039/02/27)
【発明の名称】
ポリ硫酸化多糖類を用いた術後関節痛の処置
【請求項1】
哺乳動物における無菌性持続性術後関節痛の処置のための方法で用いるための医薬組成物であって、ペントサンポリ硫酸またはその許容される塩を含み、
前記方法は、ペントサンポリ硫酸またはその許容される塩を含む前記医薬組成物を前記哺乳動物に投与するステップを含み、前記無菌性持続性術後関節痛が、関節形成術の結果生じる関節内疼痛である、医薬組成物。
-
【異議事件番号(申立日)】
2024-700492(2024/05/24)
【異議申立人/特許権者】
-/
パラダイム バイオファーマシューティカルズ リミテッド
【特許番号(満了日)】
7391858(2039/02/27)
【発明の名称】
ポリ硫酸化多糖類を用いた術後関節痛の処置
【請求項1】
哺乳動物における無菌性持続性術後関節痛の処置のための方法で用いるための医薬組成物であって、ペントサンポリ硫酸またはその許容される塩を含み、
前記方法は、ペントサンポリ硫酸またはその許容される塩を含む前記医薬組成物を前記哺乳動物に投与するステップを含み、前記無菌性持続性術後関節痛が、関節形成術の結果生じる関節内疼痛である、医薬組成物。
No.10
【関連医薬品】
-
【異議事件番号(申立日)】
2024-700465(2024/05/16)
【異議申立人/特許権者】
-/
積水メディカル株式会社
【特許番号(満了日)】
7382071(2039/09/27)
【発明の名称】
糖化ヘモグロビン(%)の測定方法
【請求項1】
HbS及びHbCのいずれかあるいは両方を含む可能性のある試料中の糖化ヘモグロビン(%)を液中で測定する方法であって、
緩衝液に含まれる不溶性担体と試料とを接触させることにより試料中の糖化ヘモグロビンを不溶性担体に吸着させる工程と、
不溶性担体に吸着した糖化ヘモグロビンと抗糖化ヘモグロビンモノクローナル抗体とを接触させることにより抗糖化ヘモグロビンモノクローナル抗体、糖化ヘモグロビン、及び不溶性担体の複合体を形成する工程と、
当該複合体と抗糖化ヘモグロビンモノクローナル抗体に反応するモノクローナル抗体であってヒトIgGとは反応しないモノクローナル抗体とを接触させることにより不溶性担体を液中で凝集させる工程と、
を含む前記糖化ヘモグロビン(%)測定方法。
-
【異議事件番号(申立日)】
2024-700465(2024/05/16)
【異議申立人/特許権者】
-/
積水メディカル株式会社
【特許番号(満了日)】
7382071(2039/09/27)
【発明の名称】
糖化ヘモグロビン(%)の測定方法
【請求項1】
HbS及びHbCのいずれかあるいは両方を含む可能性のある試料中の糖化ヘモグロビン(%)を液中で測定する方法であって、
緩衝液に含まれる不溶性担体と試料とを接触させることにより試料中の糖化ヘモグロビンを不溶性担体に吸着させる工程と、
不溶性担体に吸着した糖化ヘモグロビンと抗糖化ヘモグロビンモノクローナル抗体とを接触させることにより抗糖化ヘモグロビンモノクローナル抗体、糖化ヘモグロビン、及び不溶性担体の複合体を形成する工程と、
当該複合体と抗糖化ヘモグロビンモノクローナル抗体に反応するモノクローナル抗体であってヒトIgGとは反応しないモノクローナル抗体とを接触させることにより不溶性担体を液中で凝集させる工程と、
を含む前記糖化ヘモグロビン(%)測定方法。
No.11
【関連医薬品】
-
【異議事件番号(申立日)】
2024-700529(2024/06/04)
【異議申立人/特許権者】
-/
日本新薬株式会社
【特許番号(満了日)】
7394749(2039/05/10)
【発明の名称】
オリゴ核酸化合物の製造方法
【請求項1】
水酸基または1級のもしくは2級のアミノ基を有する化合物[A]と、次の一般式[1]:
【化1】
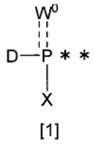
[式中、
**は結合位置を表し;
Dはハロゲン、5~6員の飽和環状アミノまたはジ(C1-6アルキル)アミノを表し;
W0は孤立電子対、酸素原子または硫黄原子を表し;および
Xは中性条件下で脱離可能な基で置換されている水酸基、1,1,3,3-テトラ(C1-6アルキル)グアニジル、C1-6アルコキシ、ジ(C1-6アルキル)アミノ、モノ(塩基性条件下で脱離可能な基で置換されているアミノ-C1-6アルキル)アミノ、ジ(塩基性条件下で脱離可能な基で置換されているアミノ-C1-6アルキル)アミノまたは次の一般式[2]:
※以下省略
-
【異議事件番号(申立日)】
2024-700529(2024/06/04)
【異議申立人/特許権者】
-/
日本新薬株式会社
【特許番号(満了日)】
7394749(2039/05/10)
【発明の名称】
オリゴ核酸化合物の製造方法
【請求項1】
水酸基または1級のもしくは2級のアミノ基を有する化合物[A]と、次の一般式[1]:
【化1】

[式中、
**は結合位置を表し;
Dはハロゲン、5~6員の飽和環状アミノまたはジ(C1-6アルキル)アミノを表し;
W0は孤立電子対、酸素原子または硫黄原子を表し;および
Xは中性条件下で脱離可能な基で置換されている水酸基、1,1,3,3-テトラ(C1-6アルキル)グアニジル、C1-6アルコキシ、ジ(C1-6アルキル)アミノ、モノ(塩基性条件下で脱離可能な基で置換されているアミノ-C1-6アルキル)アミノ、ジ(塩基性条件下で脱離可能な基で置換されているアミノ-C1-6アルキル)アミノまたは次の一般式[2]:
※以下省略
無効審判の審決
No.12
【関連医薬品】
プレセデックス静注液 200μg「ファイザー」(デクスメデトミジン塩酸塩)
プレセデックス静注液 200μg/50mL シリンジ「ファイザー」(デクスメデトミジン塩酸塩)
*用途限定との対応は未検討
【審判番号(審決日)】
2022-800038(2024/06/04)
【審判請求人(参加人)/被請求人】
ニプロ 株式会社(サンド株式会社)/
ホスピーラ インコーポレイテッド
【特許番号(満了日)】
6640164(2032/09/27)
【結論】
訂正あり、維持
【発明の名称】
デクスメデトミジンを用いて小児患者を治療する方法
【訂正請求項1】
小児患者における鎮静のための医薬組成物であって、
前記医薬組成物がデクスメデトミジンを含み、
前記医薬組成物が、鎮静が必要な、集中治療環境で、人工呼吸器が装着された小児患者の鎮静方法に用いられ、
前記方法が、前記小児患者にデクスメデトミジンを投与することを含み、
前記デクスメデトミジンを単独で0.2μg/kg/時間の濃度で投与し、
前記デクスメデトミジンの投与前に初回負荷量をさらに含み、
前記負荷量が0.2μg/kgであり、
前記小児患者が約17歳以下であり、
前記小児患者の在胎期間が36週間以上44週間未満の範囲であり、かつ
前記デクスメデトミジンを約36時間未満の時間にわたって持続注入として投与することを特徴とする、医薬組成物。
プレセデックス静注液 200μg「ファイザー」(デクスメデトミジン塩酸塩)
プレセデックス静注液 200μg/50mL シリンジ「ファイザー」(デクスメデトミジン塩酸塩)
*用途限定との対応は未検討
【審判番号(審決日)】
2022-800038(2024/06/04)
【審判請求人(参加人)/被請求人】
ニプロ 株式会社(サンド株式会社)/
ホスピーラ インコーポレイテッド
【特許番号(満了日)】
6640164(2032/09/27)
【結論】
訂正あり、維持
【発明の名称】
デクスメデトミジンを用いて小児患者を治療する方法
【訂正請求項1】
小児患者における鎮静のための医薬組成物であって、
前記医薬組成物がデクスメデトミジンを含み、
前記医薬組成物が、鎮静が必要な、集中治療環境で、人工呼吸器が装着された小児患者の鎮静方法に用いられ、
前記方法が、前記小児患者にデクスメデトミジンを投与することを含み、
前記デクスメデトミジンを単独で0.2μg/kg/時間の濃度で投与し、
前記デクスメデトミジンの投与前に初回負荷量をさらに含み、
前記負荷量が0.2μg/kgであり、
前記小児患者が約17歳以下であり、
前記小児患者の在胎期間が36週間以上44週間未満の範囲であり、かつ
前記デクスメデトミジンを約36時間未満の時間にわたって持続注入として投与することを特徴とする、医薬組成物。

コメント