<判決紹介>
平成24年(行ケ)第10419号 審決取消請求事件■コメント
裁判所は、下記(1)~(3)などを考慮して本願発明には顕著な効果が無いと判断した。 審決取消。 ☆☆☆
(1)甲16等によれば本願明細書に記載の試験結果(死亡率減少率68又は67%)は信頼性が低い。
(2)甲26によれば本願試験の死亡率減少率は約35%である。
(3)甲24(優先日後文献)によればヒソプロロールの死亡率減少率は約34%である(本願と大きな差がない)。■関連記事
・平成23年(行ケ)第10018号審決取消請求事件■抜粋
・平成24年(行ケ)第10419号 審決取消請求事件
・平成25年10月16日判決言渡、知的財産高等裁判所第3部
・原告: 沢井製薬株式会社
・被告: 第一三共株式会社
・特許: 特許3546058
・請求項1:
利尿薬,アンギオテンシン変換酵素阻害剤および/またはジゴキシンでのバックグランド療法を受けている哺乳類における虚血性のうっ血性心不全に起因する死亡率をクラスⅡからⅣの症状において同様に実質的に減少させる薬剤であって,低用量カルベジロールのチャレンジ期間を置いて6ヶ月以上投与される薬剤の製造のための,単独でのまたは1もしくは複数の別の治療薬と組み合わせたβ-アドレナリン受容体アンタゴニストとα1-アドレナリン受容体アンタゴニストの両方である下記構造: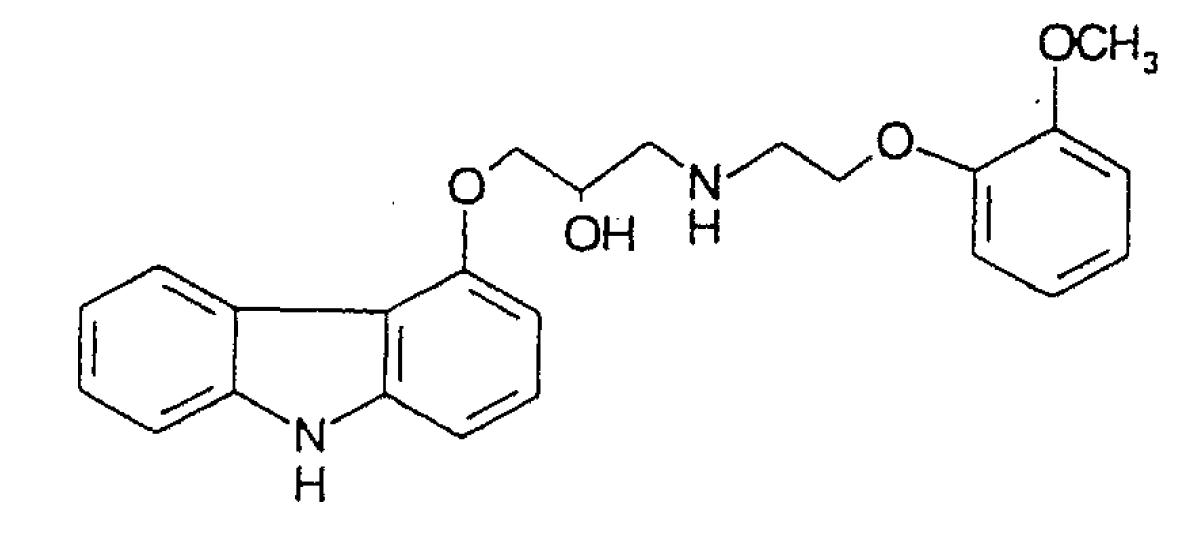
を有するカルベジロールの使用であって,前記治療薬がアンギオテンシン変換酵素阻害剤,利尿薬および強心配糖体から成る群より選ばれる,カルベジロールの使用。
・概要
主文
1 特許庁が無効2007-800192号事件について平成24年10月3 1日にした審決を取り消す。
2 訴訟費用は被告の負担とする。
事実及び理由
・・・。
第5 当裁判所の判断
当裁判所は,原告主張の取消事由のうち,取消事由2-1(甲1発明に基づく進歩性の判断の誤り),取消事由3(甲1発明,甲2発明,甲3発明,甲4発明,甲5発明及び甲6発明に基づく進歩性の判断の誤り)及び取消事由4(本件発明の効果に係る判断の誤り)はいずれも理由があり,本件発明1の進歩性に係る審決の判断は誤りであり,そうである以上,本件発明2ないし本件発明10の進歩性に係る審決の結論に影響を与えることは明らかであるから,審決は全体として違法であり,取消しを免れないものと判断する。その理由は以下のとおりである。・・・。
2 取消事由4(本件発明の効果に係る判断の誤り)について
(1) 本件発明の効果の顕著性について
ア 本件発明の死亡率低減効果について
(ア) 米国カルベジロール試験について
本件明細書(甲48の2)には,心不全患者にカルベジロールを投与することにより,心不全による死亡率をクラスⅡ患者で68%,クラスⅢ~Ⅳ患者で67%減少させたことが記載されている(前記1(1)ア)。弁論の全趣旨によれば,本件明細書に記載された米国カルベジロール試験は,甲16文献に記載された,いわゆる米国カルベジロール試験と同じ試験であることが認められる。
米国カルベジロール試験における治療期間は1日~15.1ヵ月で,治療期間の中間値は6.5ヵ月であり,この点について,甲16文献の「考察」の項には,「今回の所見を解釈するうえで,この試験プログラムは薬物治療が生存率に及ぼす影響を検討する目的にしてはいくつかの例外的特色をもつものであることを考慮に入れておく必要がある。…今回のプログラムにおいては,…追跡期間は短く,固定されたものとなった。…このようなデザインでは観察される死亡数が必然的に減少する。…このように限られた試験成績では生存率に対して一貫してどの程度の影響をもつかについて確信をもって結論を出すことはできない。」と記載されている(甲16)。この記載によれば,甲16文献の著者らは,米国カルベジロール試験は治療期間が短く,その結果,死亡率が必然的に減少すること,観察される死亡者数が少ない場合には,死亡率の減少の評価が信頼のあるデータにならないことから,甲16文献に記載されたデータについても確信をもって結論を出すことはできないと判断していることが認められる。
そして,1999年(平成11年)発行のHeart第82巻補遺Ⅳ・Ⅳ14~Ⅳ22頁掲載の論文“Major β blocker mortality trials in chronic heart failure: a critical review”(「慢性心不全における主なβ遮断薬の死亡率試験:批評的総説」,JJVMcMurray著,甲22。以下「甲22文献」という。)の「死亡率における効果」の項には,「USCP試験(判決注・米国カルベジロール試験を指す。)における死亡率減少の規模の解釈に影響を及ぼしている2つ目の重要な問題は,その経過観察期間である。短期の経過観察は治療の効果を誇張することが出来,長期の経過観察は過小評価することが出来る。」と記載されており,米国カルベジロール試験の治療期間は短く,このことが,カルベジロールによる死亡率減少効果を誇張している可能性があることが指摘されている。
また,甲21文献には「これらのデータ(判決注・米国カルベジロール試験のデータを指す。)は,食品医薬品局の心腎臓疾患諮問委員会に提示された時に,4つの研究のうち3つで主要評価項目に関してネガティブであると報告された。」(甲21)と記載され,平成21年11月16日厚生労働省医薬食品局審査管理課発出の「『抗心不全薬の臨床評価方法に関するガイドラインの改訂』に関する意見の募集について」に添付された「抗心不全薬の臨床評価方法に関するガイドライン(改訂案)」(甲23。以下「甲23文献」という。)の「2.本ガイドライン改定の主旨について」の項にも,「FDAの諮問委員会はその申請(判決注:米国カルベジロール試験による申請を指す。)を否決し,新たに未解決の問題に対処すべく評価項目を定めてプロスペクティブな試験をやり直すことを勧告した。」と記載されている。
上記各文献の記載によれば,甲16文献で示された米国カルベジロール試験の結果(心不全に起因する死亡率を減少させるカルベジロールの効果)は,その治療期間が短いために誇張されたものである可能性が高いことが認められる。
そうすると,本件明細書に記載された本件発明の効果(米国カルベジロール試験の結果)である死亡率減少率68%(クラスⅡ),67%(クラスⅢ~Ⅳ)という数値もまた誇張されたものであるといわざるを得ず,信頼性が低いものというべきである。なお,甲16文献,甲21文献,甲22文献及び甲23文献は,いずれも本件特許の優先権主張日後に発行された刊行物であるけれども,これらは,本件明細書に記載された本件発明の効果である米国カルベジロール試験の結果が信頼性が低いものであることを示すものであるので,その立証趣旨においてこれらの証拠を採用することに支障はない。
(イ) 甲26文献について
一方,甲26文献には,2289名の重度心不全患者をプラセボ投与群とカルベジロール投与群に分け,死亡率を主要評価項目として行われた臨床試験において,カルベジロールを投与した場合に死亡率を35%減少させたことが示されており,この値は心不全の原因によって差がない旨が記載されている(甲26)。
上記試験の治療経過観察期間の平均値は10.4か月であり,米国カルベジロール試験の6.5か月を上回ることも考慮すると,甲26文献に示された死亡率減少率35%という数値は,甲16文献に示された68ないし67%という数値と比較して,信頼性が高いものと認められる。
(ウ) 本件発明の死亡率低減効果
以上によれば,本件発明の死亡率減少率は約35%であると認められる。
イ 他のβ遮断薬の死亡率低減効果について
乙11文献の記載(前記1(3)コ)によれば,本件特許の優先権主張日当時,β遮断薬の一種であるビソプロロールは心不全患者の機能を有意に改善するものの,虚血性心不全の患者では死亡率を減少させる効果は有意ではなかったことが公知であったことが認められる。
甲24文献に記載された試験は,乙11文献に記載された試験を更に検証するために行われたものである。その結果について,甲24文献には,ビソプロロールのハザード比が0.66であったこと(判決注・ハザード比0.66とは,死亡率34%減少を意味する。),ビソプロロールの有益性は心不全の病因やNYHAクラスの重症度にかかわらず見られたことが記載されている(甲24)。これらの記載によれば,ビソプロロールは,虚血性の心不全に起因する死亡率をクラスⅢからⅣの症状において同様に約34%減少させる効果を有することが認められる。
なお,審決は,甲24文献においてビソプロロールによる34%の死亡率減少が記載されていることは本件特許の優先権主張日当時の技術水準を示すものではないから,これにより,本件発明の効果が顕著な効果ではないとすることはできない,と判断している。確かに,甲24文献は,本件特許の優先権主張日より後に公開された論文である。
しかし,前記のとおり,甲24文献記載の試験は,本件特許の優先権主張日以前に公開された乙11文献に記載された試験を更に検証するために行われたものである。そして,乙11文献には「…ビソプロロール投与下においてみられた20%の死亡リスク減少は,有意水準5%で統計的には有意ではなかった。しかし,この減少の95%信頼区間は,死亡率の有意な減少に見合う余地を残している。」(前記1(3)コ)と記載されている。この記載によれば,乙11文献記載の試験では,ビソプロロールの死亡率減少は20%で,統計的には死亡率減少効果がないと判断される試験結果が出たものの,再度検証を行えば,20%を上回る死亡率減少の結果が得られ,統計的にも死亡率減少効果があると判断される可能性があることが,本件特許の優先権主張日の時点において認識されていたことが認められる。
したがって,甲24文献記載の試験結果自体は,本件特許の優先権主張日当時の技術水準を示すものではないとしても,甲24文献の記載内容を参酌して本件発明の効果の顕著性について判断することに問題はない。
ウ 本件発明の死亡率低減効果の顕著性上記アで認定した本件発明における死亡率低減効果35%と,上記イで認定したビソプロロールの死亡率低減効果34%を比較すると,両者の差は1%であり,大きな差は存在しない。
そうすると,本件発明が虚血性のうっ血性心不全の死亡率を減少させる効果は,格別顕著なものとはいえないというべきである。
(2) 被告の主張及び審決のその余の認定・判断について
・・・。
ウ 審決は,本件発明の効果は顕著であると判断している。しかし,以下のとおり,その判断は誤りである。
審決は,本件特許の優先権主張日当時,カルベジロールが虚血性のうっ血性心不全に起因する死亡率を低下することは知られていなかったところ,米国カルベジロール試験は,プラセボと比較して優位な効果が確認できたことにより試験が中止されたといえるので,優先権主張日当時の技術水準からみて,本件発明の効果が顕著な効果ではないということはできないと判断している。
しかし,米国カルベジロール試験は,治療期間が短いこと等により,その結果の信頼性が低いものであることは,前記説示のとおりである。したがって,米国カルベジロール試験においてプラセボと比較して優位な効果が確認できたことにより試験が中止されたからといって,本件発明に顕著な効果があるということはできない。
(3) 小括
よって,原告主張の取消事由4(本件発明の効果に係る判断の誤り)は理由がある。
判決文はこちらから
試験結果の信頼性が低いことなどから顕著な効果が無いと判断された事例
 顕著な効果
顕著な効果
コメント